题目内容
欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
(1)某含铬废水处理的主要流程如图所示: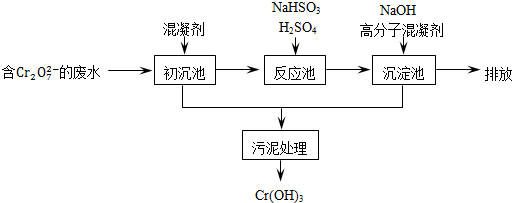
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |

①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
.②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O
Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O
.证明Cr3+沉淀完全的方法是测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全
.
(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强
.用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是8.48
8.48
g.分析:(1)①氢氧化铝能吸附悬浮物,所以作混凝剂;
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O,反应后溶液中有H+、Cr3+,加NaOH溶液,NaOH会和H+、Cr3+发生反应;
(2)Fe2+离子与Cr2O72-离子发生氧化还原反应生成Fe3+离子和Cr3+离子;随着电解进行,溶液中c(H+) 逐渐减少,c(OH-)浓度增大;根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓进行计算;
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O,反应后溶液中有H+、Cr3+,加NaOH溶液,NaOH会和H+、Cr3+发生反应;
(2)Fe2+离子与Cr2O72-离子发生氧化还原反应生成Fe3+离子和Cr3+离子;随着电解进行,溶液中c(H+) 逐渐减少,c(OH-)浓度增大;根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓进行计算;
解答:解:(1)①K2SO4﹒Al2(SO4)3﹒24H2O为强电解质,在溶液中完全电离,生成Al3+和SO42-、K+,Al3+能水解生成氢氧化铝胶体:Al3++3H2O=Al(OH)3(胶体)+3H+或Al3++3H2O?Al(OH)3+3H+,氢氧化铝胶体具有吸附性,能吸附水中的悬浮物,所以能作净水剂,
故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+或Al3++3H2O?Al(OH)3+3H+;
②根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,NaOH会和H+发生反应H++OH-═H2O,Cr3+与NaOH发生反应Cr3++3OH-═Cr(OH)3↓,Cr(OH)3沉淀完全时的pH为8,所以,测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全,
故答案为:Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O;测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全;
(2)亚铁离子与Cr2O72-发生氧化还原反应,被还原为Cr3+然后生成Cr(OH)3沉淀,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;随着电解进行,溶液中c(H+) 逐渐减少,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强,生成Fe(OH)3和Cr(OH)3沉淀,金属阳离子在阴极区可沉淀完全;根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓知0.01mol Cr2O72-,可生成0.02molCr(OH)3,0.06molFe(OH)3,至少得到沉淀的质量是0.02mol×103g/mol+0.06mol×107g/mol=8.48g,
故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强;8.48;
故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+或Al3++3H2O?Al(OH)3+3H+;
②根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,NaOH会和H+发生反应H++OH-═H2O,Cr3+与NaOH发生反应Cr3++3OH-═Cr(OH)3↓,Cr(OH)3沉淀完全时的pH为8,所以,测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全,
故答案为:Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O;测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全;
(2)亚铁离子与Cr2O72-发生氧化还原反应,被还原为Cr3+然后生成Cr(OH)3沉淀,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;随着电解进行,溶液中c(H+) 逐渐减少,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强,生成Fe(OH)3和Cr(OH)3沉淀,金属阳离子在阴极区可沉淀完全;根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓知0.01mol Cr2O72-,可生成0.02molCr(OH)3,0.06molFe(OH)3,至少得到沉淀的质量是0.02mol×103g/mol+0.06mol×107g/mol=8.48g,
故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;阴极反应消耗了水中的H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强;8.48;
点评:本题考查较为综合,涉及电解、氧化还原反应、化学方程式的计算等问题,要求具有较好的分析和解决问题的能力,题目难度较大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
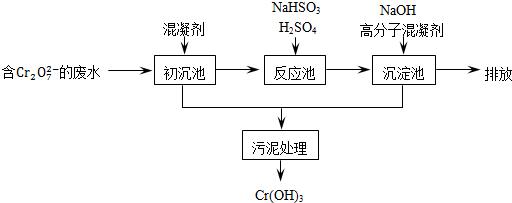
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,用离子方程式表示其反应原理是______.
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是______.证明Cr3+沉淀完全的方法是______.

(2)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是______,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是______.用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是______ g.



