题目内容
 (2013?德州模拟)铁、铝及其化合物在生产和生活中有着广泛的应用.
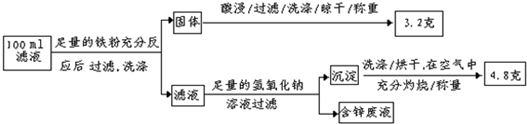
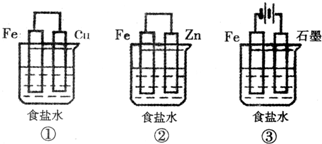
(2013?德州模拟)铁、铝及其化合物在生产和生活中有着广泛的应用.(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是
①
①
(填装置序号),该装置中正极电极反应式为O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;为防止金属Fe被腐蚀,可以采用上述②③
②③
(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为2Cl-+2H2O
H2↑+Cl2↑+2OH-
| ||
2Cl-+2H2O
H2↑+Cl2↑+2OH-
.
| ||
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车.
电池反应为FePO4+Li
| 放电 |
| 充电 |
正
正
极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为FePO4+Li++e-=LiFePO4
FePO4+Li++e-=LiFePO4
.(3)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入氯化铝,试说明氯化铝的作用
氯化铝溶于水,Al3+发生水解:Al3++3H2O?Al(OH)3+3H+,生成Al(OH)3胶体,能吸附镉的难溶物而发生聚沉(或沉降、沉淀或沉积下来),从而消除Cd2+污染
氯化铝溶于水,Al3+发生水解:Al3++3H2O?Al(OH)3+3H+,生成Al(OH)3胶体,能吸附镉的难溶物而发生聚沉(或沉降、沉淀或沉积下来),从而消除Cd2+污染
(用必要的离子方程式和文字进行解释).分析:(1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;
(2)原电池中阳离子移向正极;依据总反应方程式和负极电极反应计算得到正极电极反应式;
(3)铝离子水解生成氢氧化铝胶体,胶体具有吸附作用能吸附杂质难溶物形成沉淀.
(2)原电池中阳离子移向正极;依据总反应方程式和负极电极反应计算得到正极电极反应式;
(3)铝离子水解生成氢氧化铝胶体,胶体具有吸附作用能吸附杂质难溶物形成沉淀.
解答:解:(1))①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;①组装置中铁电极腐蚀最快;正极反应是氧气得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-;②③装置中铁被保护;装置③中发生的是电解饱和食盐水的反应,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子发生还原反应,反应离子方程式为:2Cl-+2H2O
H2↑+Cl2↑+2OH-;
故答案为:①; O2+2H2O+4e-=4OH-;②③; 2Cl-+2H2O
H2↑+Cl2↑+2OH-;
(2)FePO4+Li
LiFePO4 放电过程是原电池,总反应方程式减去负极反应得到正极电极反应:FePO4+Li++e-=LiFePO4;
故答案为:正;FePO4+Li++e-=LiFePO4;
(3)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入氯化铝,氯化铝水解生成氢氧化铝胶体具有吸附悬浮杂质的作用,可以把生成的难溶物吸附聚沉消除镉离子的 污染;
故答案为:氯化铝溶于水,Al3+发生水解:Al3++3H2O?Al(OH)3+3H+,生成Al(OH)3胶体,能吸附镉的难溶物而发生聚沉(或沉降、沉淀或沉积下来),从而消除Cd2+污染.
| ||
故答案为:①; O2+2H2O+4e-=4OH-;②③; 2Cl-+2H2O
| ||
(2)FePO4+Li
| 放电 |
| 充电 |
故答案为:正;FePO4+Li++e-=LiFePO4;
(3)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入氯化铝,氯化铝水解生成氢氧化铝胶体具有吸附悬浮杂质的作用,可以把生成的难溶物吸附聚沉消除镉离子的 污染;
故答案为:氯化铝溶于水,Al3+发生水解:Al3++3H2O?Al(OH)3+3H+,生成Al(OH)3胶体,能吸附镉的难溶物而发生聚沉(或沉降、沉淀或沉积下来),从而消除Cd2+污染.
点评:本题考查了金属腐蚀与防护的方法和应用,原电池电极反应书写方法,电解池反应离子方程式的书写应用,重金属除杂方法的理解,题目难度中等.

练习册系列答案
相关题目


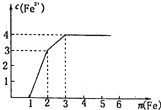 (2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
(2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )