摘要:24.纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱中碳酸钠的质量分数.设计了下列三种实验方案进行探究.请填空: 方案一:纯碱样品测定剩余固体质量 (1)分别称取干燥坩埚和纯碱样品的质量.将纯碱样品放入坩埚中充分加热.坩埚中发生反应的化学方程式为 . (2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热一冷却一称量 操作多次.其目的是 . 方案二:纯碱样品溶液测定沉淀质量 (3)称取m 1g样品.置于小烧杯中.加水溶解.向小烧杯中滴加足量氯化钙溶液.将反应混和物过滤后的下一步操作是 . (4)沉淀经干燥后称量为m 2g,则该样品中碳酸钠的质量分数为 . (5)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂.在其他操作正确的情况下.测得样品中的碳酸钠质量分数将比实际 (填“偏高 .“偏低 或“不变 ). 方案三:纯碱样品测定生成CO2的质量 (6)本实验采用右图装置.C中盛放的物质是 . (7)反应前后都要通入N2.反应后通入N2的目的是 .
网址:http://m.1010jiajiao.com/timu3_id_56377[举报]
 (2009?厦门二模)纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
(2009?厦门二模)纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:方案一:纯碱样品
| 加热 |
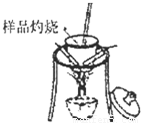
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为:
2NaHCO3
Na2CO3+CO2↑+H2O
| ||
2NaHCO3
Na2CO3+CO2↑+H2O
.
| ||
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是:
加热至恒重,以保证NaHCO3全部分解
加热至恒重,以保证NaHCO3全部分解
.
方案二:纯碱样品溶液
| 氯化钙溶液 |
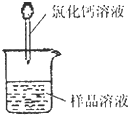
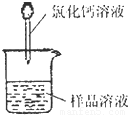
(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是:
洗涤沉淀
洗涤沉淀
.(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为:
| 106m2 |
| m1 |
| 106m2 |
| m1 |
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际
不变
不变
(填“偏高”、“偏低”或“不变”).方案三:纯碱样品
| 硫酸 |
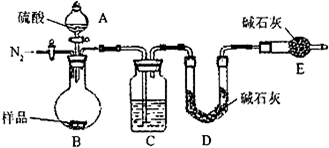
(1)本实验采用vk图装置,C中盛放的物质是
浓硫酸
浓硫酸
.(2)反应前后都要通入N2,反应后通入N2的目的是:
排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收
排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收

 纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
方案一:纯碱样品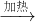 测定剩余固体质量
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放人坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为:______.
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是:______.
方案二:纯碱样品溶液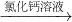 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是:______.
(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为:______.
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际______(填“偏高”、“偏低”或“不变”).
方案三:纯碱样品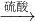 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用vk图装置,C中盛放的物质是______.
(2)反应前后都要通人N2,反应后通入N2的目的是:______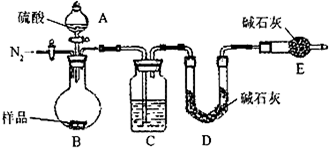
查看习题详情和答案>>
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
方案一:纯碱样品
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放人坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为:______.
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是:______.
方案二:纯碱样品溶液
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是:______.
(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为:______.
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际______(填“偏高”、“偏低”或“不变”).
方案三:纯碱样品
测定生成二氧化碳的质量
(1)本实验采用vk图装置,C中盛放的物质是______.
(2)反应前后都要通人N2,反应后通入N2的目的是:______
查看习题详情和答案>>
方案一:纯碱样品
| 加热 |
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放人坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为:______.
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是:______.

方案二:纯碱样品溶液
| 氯化钙溶液 |
(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是:______.
(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为:______.
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际______(填“偏高”、“偏低”或“不变”).
方案三:纯碱样品
| 硫酸 |
(1)本实验采用vk图装置,C中盛放的物质是______.
(2)反应前后都要通人N2,反应后通入N2的目的是:______


纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为: .
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是: .
方案二:纯碱样品溶液 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是: .
(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为: .
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际 (填“偏高”、“偏低”或“不变”).
方案三:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用vk图装置,C中盛放的物质是 .
(2)反应前后都要通入N2,反应后通入N2的目的是: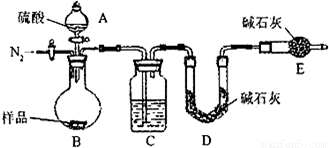
 查看习题详情和答案>>
查看习题详情和答案>>
方案一:纯碱样品
 测定剩余固体质量
测定剩余固体质量(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为: .
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是: .
方案二:纯碱样品溶液
 测定沉淀质量
测定沉淀质量(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是: .
(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为: .
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际 (填“偏高”、“偏低”或“不变”).
方案三:纯碱样品
 测定生成二氧化碳的质量
测定生成二氧化碳的质量(1)本实验采用vk图装置,C中盛放的物质是 .
(2)反应前后都要通入N2,反应后通入N2的目的是:


 查看习题详情和答案>>
查看习题详情和答案>>
 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍.写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:
O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.铁锈的主要成分是Fe2O3?xH2O
Fe2O3?xH2O
(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(2)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O
| ||
| 充电 |
①此装置中爱迪生蓄电池的负极是
a
a
(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是氧化反应
氧化反应
.②写出在用电解法制取高铁酸钠时,阳极的电极反应式
Fe-6e-+8OH-=FeO42-+4H2O
Fe-6e-+8OH-=FeO42-+4H2O
.③你认为高铁酸钠作为一种新型净水剂的理由可能是
BC
BC
.A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质.