摘要:9.在一定条件下.可逆反应:N2+3H2 2NH3,△H<0 达到平衡.当单独改变下列条件后.有关叙述错误的是( ) A.加催化剂.v正.v逆都发生变化且变化的倍数相等 B.加压.v正.v逆都增大.且v正增大倍数大于v逆增大倍数 C.降温.v正.v逆都减小.且v正减小倍数大于v逆减小倍数 D.加入氩气.v正.v逆都增大.且v正增大倍数大于v逆增大倍数
网址:http://m.1010jiajiao.com/timu3_id_56119[举报]
(1)在一定条件下,可逆反应达到平衡状态的本质特征是 2NH3(g)已经达到平衡状态的是
2NH3(g)已经达到平衡状态的是
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
(2)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a各物质的浓度不变,b平衡混合物中各组份的物质的量分数或质量分数不变,c容器内气体压强不变,d容器内气体密度不变,e容器内气体颜色不变.
①能说明反应N2(g)+3H2(g)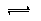 2NH3(g)达到平衡状态的有
2NH3(g)达到平衡状态的有
②能说明反应H2(g)+I2(g)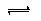 2HI(g)达到平衡状态的有
2HI(g)达到平衡状态的有
③能说明反应2NO2(g)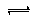 N2O4(g)达到平衡状态的有
N2O4(g)达到平衡状态的有
④能说明反应C(s)+H2O(g)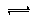 CO(g)+H2(g)达到平衡状态的有
CO(g)+H2(g)达到平衡状态的有
查看习题详情和答案>>
正反应速率与逆反应速率相等
正反应速率与逆反应速率相等
,下列关系中能说明反应N2(g)+3H2(g) 2NH3(g)已经达到平衡状态的是
2NH3(g)已经达到平衡状态的是C
C
.A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
(2)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a各物质的浓度不变,b平衡混合物中各组份的物质的量分数或质量分数不变,c容器内气体压强不变,d容器内气体密度不变,e容器内气体颜色不变.
①能说明反应N2(g)+3H2(g)
 2NH3(g)达到平衡状态的有
2NH3(g)达到平衡状态的有abc
abc
;②能说明反应H2(g)+I2(g)
 2HI(g)达到平衡状态的有
2HI(g)达到平衡状态的有abe
abe
;③能说明反应2NO2(g)
 N2O4(g)达到平衡状态的有
N2O4(g)达到平衡状态的有abce
abce
;④能说明反应C(s)+H2O(g)
 CO(g)+H2(g)达到平衡状态的有
CO(g)+H2(g)达到平衡状态的有abcd
abcd
.下列关于化学反应的速率和限度的说法正确的是( )
| A、化学反应速率通常只能用反应物浓度的减少量表示 | B、在一定条件下,可逆反应处于平衡状态时就达到了该反应的限度 | C、化学平衡状态指的是指化学反应不再进行的状态 | D、加入催化剂一定加快化学反应速率 |
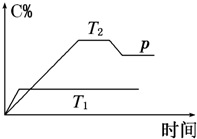 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:(1)温度T1
>
>
T2(填“>”“=”或“<”).(2)正反应是
放热
放热
反应(填“吸热”或“放热”).(3)如果A、B、C均为气体,则m
>
>
2(填“>”“=”或“<”).(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强
增大
增大
(填“增大”“减小”或“不变”),平衡不
不
移动(填“向正反应方向”“向逆反应方向”或“不”).(5)已知2A(g)+B(g)?2C(g)△H=-a kJ?mol-1(a>0),在一个有催化剂的固定容积的容器中加入2mol A和1mol B,在500℃时充分反应达平衡后C的浓度为ω mol/L,放出热量b kJ.
①a
>
>
b(填“>”“=”或“<”).②若将反应温度升高到700℃,该反应的平衡常数将
减小
减小
(填“增大”“减小”或“不变”).③在上述容器中为使该反应的反应速率增大,且平衡向正反应方向移动的可采取的措施是
增大A2的浓度,或增大B2的浓度或同时增大A2、B2的浓度
增大A2的浓度,或增大B2的浓度或同时增大A2、B2的浓度
(说出一种即可)下表是元素周期表的一部分,、A、B、C、D、E、X、Y是下表中给出元素组成的常见单质或化合物.
I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)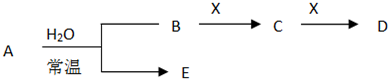
(1)若E为氧化物,则 A与水反应的化学方程式为
①当X是碱性盐溶液,C分子中有22个电子时,则X呈碱性的离子方程式为
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
(2)若E为单质气体,D为白色沉淀,A的化学式可能是(填两种)
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式
II.元素周期表是人们研究物质性质的重要工具.
(1)As的原子结构示意图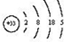
 .其氢化物的化学式
.其氢化物的化学式
(2)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂.As可与Y的水溶液反应,生成As的最高价含氧酸,该反应的化学方程式为
查看习题详情和答案>>
| ① | |||||||||||||||||
| ④ | ⑤ | ⑥ | |||||||||||||||
| ② | ③ | ⑦ | |||||||||||||||
| Fe | As | ||||||||||||||||
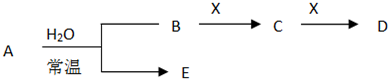
(1)若E为氧化物,则 A与水反应的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.①当X是碱性盐溶液,C分子中有22个电子时,则X呈碱性的离子方程式为
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
Fe+4H++NO3-═Fe3++NO↑+2H2O
Fe+4H++NO3-═Fe3++NO↑+2H2O
.(2)若E为单质气体,D为白色沉淀,A的化学式可能是(填两种)
Na、Na2O2或NaH
Na、Na2O2或NaH
,B含有的化学键类型为离子键和极性共价键
离子键和极性共价键
,C与X反应的离子方程式为3AlO2-+Al3++6H2O═4Al(OH)3↓
3AlO2-+Al3++6H2O═4Al(OH)3↓
.(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式
CO+H2O?CO2+H2
CO+H2O?CO2+H2
.II.元素周期表是人们研究物质性质的重要工具.
(1)As的原子结构示意图
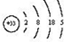
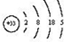
AsH3
AsH3
.(2)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂.As可与Y的水溶液反应,生成As的最高价含氧酸,该反应的化学方程式为
5NaClO+2As+3H2O═2H3AsO4+5NaCl
5NaClO+2As+3H2O═2H3AsO4+5NaCl
.当消耗1mol还原剂时,电子转移了5
5
mol.