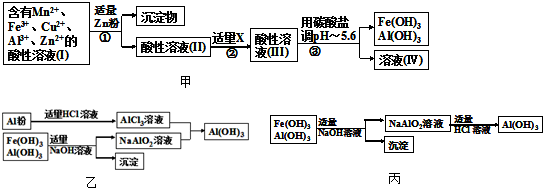
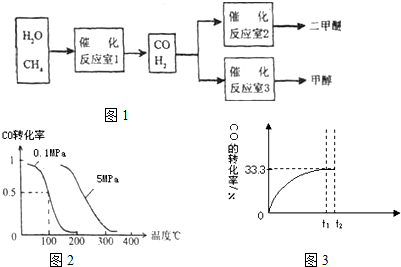
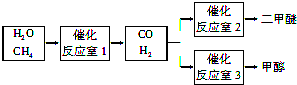
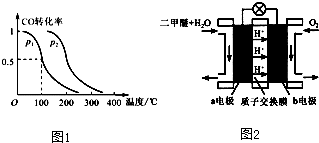
题目内容
(1)在一定条件下,可逆反应达到平衡状态的本质特征是 2NH3(g)已经达到平衡状态的是
2NH3(g)已经达到平衡状态的是
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
(2)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a各物质的浓度不变,b平衡混合物中各组份的物质的量分数或质量分数不变,c容器内气体压强不变,d容器内气体密度不变,e容器内气体颜色不变.
①能说明反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的有
2NH3(g)达到平衡状态的有
②能说明反应H2(g)+I2(g) 2HI(g)达到平衡状态的有
2HI(g)达到平衡状态的有
③能说明反应2NO2(g) N2O4(g)达到平衡状态的有
N2O4(g)达到平衡状态的有
④能说明反应C(s)+H2O(g) CO(g)+H2(g)达到平衡状态的有
CO(g)+H2(g)达到平衡状态的有
正反应速率与逆反应速率相等
正反应速率与逆反应速率相等
,下列关系中能说明反应N2(g)+3H2(g) 2NH3(g)已经达到平衡状态的是
2NH3(g)已经达到平衡状态的是C
C
.A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
(2)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a各物质的浓度不变,b平衡混合物中各组份的物质的量分数或质量分数不变,c容器内气体压强不变,d容器内气体密度不变,e容器内气体颜色不变.
①能说明反应N2(g)+3H2(g)
 2NH3(g)达到平衡状态的有
2NH3(g)达到平衡状态的有abc
abc
;②能说明反应H2(g)+I2(g)
 2HI(g)达到平衡状态的有
2HI(g)达到平衡状态的有abe
abe
;③能说明反应2NO2(g)
 N2O4(g)达到平衡状态的有
N2O4(g)达到平衡状态的有abce
abce
;④能说明反应C(s)+H2O(g)
 CO(g)+H2(g)达到平衡状态的有
CO(g)+H2(g)达到平衡状态的有abcd
abcd
.分析:(1)可逆反应达到平衡状态的本质特征是正逆反应速率相等;
达到平衡时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质)
(2)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断.解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
达到平衡时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质)
(2)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断.解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:解:(1)在一定条件下,可逆反应达到平衡状态的本质特征是正逆反应速率相等;
A、都表示正反应速率,自始至终都按照该关系进行,不能说明到达平衡状态,故A错误;
B、v正(N2)=v逆(NH3),正逆反应速率之比不等于化学计量数之比,反应未达平衡状态,故B错误;
C、2v正(H2)=3v逆(NH3),正逆反应速率之比等于化学计量数之比,反应达平衡状态,故C正确;
D、v正(N2)=3v逆(H2),正逆反应速率之比不等于化学计量数之比,反应未达平衡状态,故D错误;
故答案为:正反应速率与逆反应速率相等,C;
(2)a各物质的浓度不变,b平衡混合物中各组份的物质的量分数或质量分数不变,说明反应达平衡状态,故对①②③④ab都正确,故ab都选;
①反应N2(g)+3H2(g)?2NH3(g),该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故c正确;
根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
整个体系没有颜色,颜色不能作为判断平衡的标志,故e错误;
故答案为:a b c;
②反应H2(g)+I2(g)?2HI(g),该反应是反应前后气体体积不变的反应,容器的体积不变,所以体系压强始终不变,不能作为化学平衡状态的判断依据,故c错误;
根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
容器内气体颜色不变,说明I2浓度不变化,为定值,反应到达平衡状态,故e正确.
故答案为:abe;
③反应2NO2(g)?N2O4(g),该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故c正确;
根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
容器内气体颜色不变,说明NO2浓度不变化,为定值,反应到达平衡状态,故e正确.
故答案为:abce
④反应C(s)+H2O(g)?CO(g)+H2(g),该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故c正确;
根据质量守恒,C是固体,随着反应进行,气体的质量在增加,体积不变,气体的总质量不发生变化时,密度不再发生变化,说明到达平衡状态,故d正确;
气体的质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
整个体系没有颜色,颜色不能作为判断平衡的标志,故e错误;
故答案为:abcd
A、都表示正反应速率,自始至终都按照该关系进行,不能说明到达平衡状态,故A错误;
B、v正(N2)=v逆(NH3),正逆反应速率之比不等于化学计量数之比,反应未达平衡状态,故B错误;
C、2v正(H2)=3v逆(NH3),正逆反应速率之比等于化学计量数之比,反应达平衡状态,故C正确;
D、v正(N2)=3v逆(H2),正逆反应速率之比不等于化学计量数之比,反应未达平衡状态,故D错误;
故答案为:正反应速率与逆反应速率相等,C;
(2)a各物质的浓度不变,b平衡混合物中各组份的物质的量分数或质量分数不变,说明反应达平衡状态,故对①②③④ab都正确,故ab都选;
①反应N2(g)+3H2(g)?2NH3(g),该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故c正确;
根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
整个体系没有颜色,颜色不能作为判断平衡的标志,故e错误;
故答案为:a b c;
②反应H2(g)+I2(g)?2HI(g),该反应是反应前后气体体积不变的反应,容器的体积不变,所以体系压强始终不变,不能作为化学平衡状态的判断依据,故c错误;
根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
容器内气体颜色不变,说明I2浓度不变化,为定值,反应到达平衡状态,故e正确.
故答案为:abe;
③反应2NO2(g)?N2O4(g),该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故c正确;
根据质量守恒,无论反应是否达平衡状态,混合物质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
容器内气体颜色不变,说明NO2浓度不变化,为定值,反应到达平衡状态,故e正确.
故答案为:abce
④反应C(s)+H2O(g)?CO(g)+H2(g),该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故c正确;
根据质量守恒,C是固体,随着反应进行,气体的质量在增加,体积不变,气体的总质量不发生变化时,密度不再发生变化,说明到达平衡状态,故d正确;
气体的质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
整个体系没有颜色,颜色不能作为判断平衡的标志,故e错误;
故答案为:abcd
点评:本题主要考查平衡平衡状态的判断,可以抓住本质特征:υ正=υ逆(同种物质),解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目