摘要:26.有A.B.C.D.E五种短周期元素.它们的原子序数依次增大.其中B是地壳中含量最多的元素.已知A.C及B.E分别是同主族元素.且B.E两元素原子核内质子数之和是A.C两元素原子核内质子数之和的2倍.处于同周期的C.D.E元素中.D是该周期金属元素中金属性最弱的元素. (1)试比较C.D两元素最高价氧化物对应水化物碱性的强弱 > , (2)A.B.C形成的化合物的晶体类型为 ,电子式为 , (3) 写出D单质与C元素最高价氧化物对应水化物反应的离子方程式 , (4)写出两种均含A.B.C.E四种元素的化合物在溶液中相互反应.且生成气体的离子方程式 , (5)A单质和B单质能构成电池.该电池用多孔惰性电极浸入浓KOH溶液.两极分别通入A单质和B单质.写出该电池负极电极反应方程式 , (6)通常条件下. C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ.试写出表示该热量变化的离子方程式 .
网址:http://m.1010jiajiao.com/timu3_id_55145[举报]
有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:C
(2)写出A、B、C形成的化合物M的电子式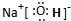
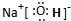 ;
;
(3)实验测得DE3 在熔融状态下不导电,则DE3 中含有的化学键类型为
(4)D单质与M的水溶液反应的离子方程式:
查看习题详情和答案>>
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C
钠
钠
,E氯
氯
;(2)写出A、B、C形成的化合物M的电子式
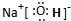
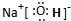
(3)实验测得DE3 在熔融状态下不导电,则DE3 中含有的化学键类型为
共价键
共价键
;(4)D单质与M的水溶液反应的离子方程式:
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
. 有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.
有A、B、C、D、E五种短周期元素,它们的原子序数由A到E依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物.D为原子核内有12个中子的二价金属,当2.4克D与盐酸反应时,在标准状况下放出气体2.24L.试根据以上叙述回答:
(1)写出元素名称:A
碳
碳
E硫
硫
,写出D的原子符号2412Mg
2412Mg
(标出质子数和质量数)(2)画出C的原子结构示意图


(3)写出AB2与C2B2反应的化学方程式
2CO2+2Na2O2=2Na2CO3+O2
2CO2+2Na2O2=2Na2CO3+O2
.(4)比较B和E的气态氢化物的稳定性(用化学式回答):
H2O>H2S
H2O>H2S
.(5)判断C元素和D元素的金属性强弱,简要地说明你的一个判断依据:
金属性 Na>Mg,钠跟冷水能反应,镁和冷水不反应 或其他合理答案
金属性 Na>Mg,钠跟冷水能反应,镁和冷水不反应 或其他合理答案
. 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同.
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题:
(1)A与E形成的化合物的化学式是
Al2O3
Al2O3
化学键类型离子键
离子键
(2)B的最高价氧化物化学式为
P2O5
P2O5
化学键类型共价键
共价键
C的元素名称为硫
硫
,D的单质与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO
Cl2+H2O?H++Cl-+HClO
.(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清
先有白色胶状沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清
,有关反应的离子方程式为Al3++3OH-=Al(OH)3↓; Al(OH)3+OH-=AlO2-+2H2O
Al3++3OH-=Al(OH)3↓; Al(OH)3+OH-=AlO2-+2H2O
.有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.
(1)B、C两元素按原子个数1:1组成的化合物F中的阴阳离子比为
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式:
(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应,且生成气体的化学方程式:
(5)D的氢化物分子中,D原子的杂化方式是
查看习题详情和答案>>
(1)B、C两元素按原子个数1:1组成的化合物F中的阴阳离子比为
1:2
1:2
,F中既存在离子键又存在非极性
非极性
共价键(填“极性”或“非极性”).(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
HClO4
HClO4
>H2SO4
H2SO4
.(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式:
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应,且生成气体的化学方程式:
NaHSO4+NaHSO3═Na2SO4+H2O+SO2↑
NaHSO4+NaHSO3═Na2SO4+H2O+SO2↑
.(5)D的氢化物分子中,D原子的杂化方式是
sp3
sp3
,空间构型是V形
V形
. 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2.E的阳离子与A的阴离子核外电子层结构完全相同.
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2.E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题:
(1)五种元素的名称:A
氧
氧
,B磷
磷
,C硫
硫
,D氯
氯
,E铝
铝
.(2)B、C、D元素的原子半径由大到小的顺序为
r(P)>r(S)>r(Cl)
r(P)>r(S)>r(Cl)
,它们的最高价氧化物对应水化物的酸性强弱顺序为HClO4>H2SO4>H3PO4
HClO4>H2SO4>H3PO4
.(3)写出C单质在足量A单质中燃烧后的产物与D单质同时通入水中的化学方程式
SO2+Cl2+2H2O═H2SO4+2HCl
SO2+Cl2+2H2O═H2SO4+2HCl
.(4)A与E形成的化合物的化学式是
Al2O3
Al2O3
,它的性质决定了它在物质的分类中应属于两性氧化物
两性氧化物
.(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是
有白色沉淀生成,当达到最大量时又逐渐减少,最终沉淀完全消失,变成澄清溶液
有白色沉淀生成,当达到最大量时又逐渐减少,最终沉淀完全消失,变成澄清溶液
,有关反应的离子方程式为Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O
Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O
.