题目内容
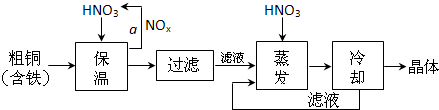
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
①在步骤a中,还需要通入氧气和水,其目的是________.
②杂质铁与足量稀硝酸反应的离子方程式为________.在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在________范围.
不用加水的方法调节溶液pH的原因是________.
③最后一步所得晶体应采用少量95%酒精淋洗后晾干.用酒精淋洗的优点是________.
(2)下图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是________(填字母).
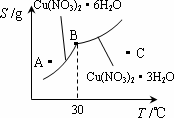
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(3)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离.由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.Cu与液态N2O4反应制得无水硝酸铜的化学方程式是________.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案(选修—化学与技术)(15分)
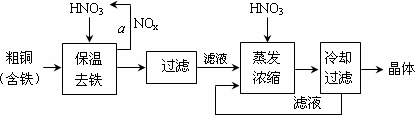
(1)工业上以粗铜为原料采取如图1所示流程制备硝酸铜晶体:
①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,根据下表数据,溶液的pH值应保持在 范围。调节pH值时,可以向溶液中加入的试剂是( )
(a) NaOH溶液 (b) 氨水 (c) Cu(OH)2 (d) CuO
|
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
③在操作Ⅰ之前,对滤液用HNO3调节pH值至1,其目的是(结合离子方程式说明) 。
④从滤液中制取硝酸铜晶体的操作Ⅰ的具体步骤是 。
(2)图2是某小组学生查阅资料后所绘出的硝酸铜晶体[Cu(NO3)2nH2O]的溶解度曲线(温度在300C左右对应不同的晶体),下列说法正确的是( )
(a) A点时的溶液为不饱和溶液
(b) B点时两种晶体可以共存
(c)按上述流程最终得到的晶体一定是Cu(NO3)2 3H2O
(d) 若将C点时的溶液降温至300C以下,可以析出Cu(NO3)2 6H2O晶体

 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解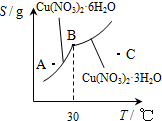
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是