摘要:氢键是( ) A.化学键 B.极性键 C.分子间作用力 D.无法确定 H3O++CO32- B.NaHSO4溶液与Ba(OH)2溶液混合呈中性:2HSO4-+Ba2++2OH-=BaSO4↓+SO42-+2H2O C.将少量铁粉加入到过量的稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O D.碳酸氢钙溶液中加入足量石灰水:Ca2++HCO3-+OH-= CaCO3↓+H2O
网址:http://m.1010jiajiao.com/timu3_id_54424[举报]
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别位于同一主族,A是自然界中原子半径最小的元素,B的最外层电子数是内层电子数的3倍.
(1)写出B的元素符号:B
 ;
;
(2)B与D的氢化物较稳定的是
(3)写出C2B2的电子式
 ;写出实验室制取DB2的化学方程式:
;写出实验室制取DB2的化学方程式:
(4)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式
查看习题详情和答案>>
(1)写出B的元素符号:B
O
O
,C的原子结构示意图

(2)B与D的氢化物较稳定的是
H2O
H2O
(填化学式),其中所含有的化学键类型为极性键
极性键
;(3)写出C2B2的电子式


Na2SO3+H2SO4═Na2SO4+H2O+SO2↑
Na2SO3+H2SO4═Na2SO4+H2O+SO2↑
(4)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
.A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的原子结构示意图为
 ;化合物BA4的电子式为
;化合物BA4的电子式为
 .
.
(2)化合物Y2X2中含有的化学键类型有
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为
查看习题详情和答案>>
(1)Z的原子结构示意图为




(2)化合物Y2X2中含有的化学键类型有
AC
AC
(填序号).A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是
H2O
H2O
(填化学式),其主要原因H2O中存在氢键
H2O中存在氢键
.(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为
H2O2+H2S═2H2O+S↓
H2O2+H2S═2H2O+S↓
. 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.I.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):
(1)对于氢氧燃料电池中,下列表达不正确的是
CD
CD
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2
| ||
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol?L-1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=
1
1
(溶液体积变化忽略不计)II氢气是合成氨的重要原料.工业上合成氨的反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.20kJ?mol-1.
(1)下列事实中,不能说明上述可逆反应已达到平衡的是
②③
②③
(填序号)①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N-H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为
27.66kJ
27.66kJ
②此条件下该反应的化学平衡常数K=
| 4 |
| 27 |
| 4 |
| 27 |
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向
正反应
正反应
方向移动(填“正反应”或“逆反应”、“不移动”).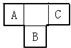 A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.D与A同周期,其最高正价与最低负价代数和为零.A、E可形成AE3型分子,分子中只存在极性键.
A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.D与A同周期,其最高正价与最低负价代数和为零.A、E可形成AE3型分子,分子中只存在极性键. (1)B元素在元素周期表中的位置是
第三周期VIA族
第三周期VIA族
.(2)C的离子结构示意图为




(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有
离子键、极性共价键
离子键、极性共价键
.(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可)
2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
(或其他合理方法)
(或其他合理方法)
2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
(或其他合理方法)
.(或其他合理方法)
A、B、C、D、E五种元素中,A原子第三能层轨道上成对电子数等于未成对电子数,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,C的价电子排布式为nsnnpn+2,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A的最高价氧化物的化学式为
(2)AC2与BC2分子的立体结构分别是
(3)D的元素符号是
(4)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键
查看习题详情和答案>>
(1)A的最高价氧化物的化学式为
SO3
SO3
,中心原子的VSEPR构型为平面三角形
平面三角形
.(2)AC2与BC2分子的立体结构分别是
V形
V形
和直线形
直线形
,相同条件下两者在水中的溶解度较大的是SO2
SO2
(写分子式),理由是SO2与水都为为极性分子,根据相似相溶的性质可知易溶于水
SO2与水都为为极性分子,根据相似相溶的性质可知易溶于水
.(3)D的元素符号是
Cr
Cr
,它的价电子排布式为3d54s1
3d54s1
,在形成化合物时它的最高化合价为+6
+6
.(4)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键
F-H…F、F-H…O、O-H…F、O-H…O
F-H…F、F-H…O、O-H…F、O-H…O
.