摘要:25.在298K.1.01×105Pa下.将22g CO2通入1mol·L-1 NaOH溶液750mL中充分反应.测得反应放出x kJ的热量.已知该条件下.1mol CO2通入2mol·L-1 NaOH溶液1L中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的 ( ) A.CO2=NaHCO3kJ·mol-1 B.CO2=NaHCO3kJ·mol-1 C.CO2=NaHCO3kJ·mol-1 D.2CO2=2NaHCO3kJ·mol-1 [解析]:n(CO2)=0.5mol,n=0.75mol ; 2CO2=NaHCO3(aq)+Na2CO3(aq) △H=-4xkJ·mol-1 n(CO2)=1mol,n=2mol , CO2=Na2CO3(aq) △H=-ykJ·mol-1 根据盖斯定律得到:CO2=NaHCO3kJ·mol-1 [答案]:C
网址:http://m.1010jiajiao.com/timu3_id_54239[举报]
在298K、1.01×105Pa下,将22g CO2通入1mol?L-1NaOH溶液750mL中充分反应,测得反应放出x kJ的热量.已知该条件下,1mol CO2通入2mol?L-1NaOH溶液1L中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的( )
查看习题详情和答案>>
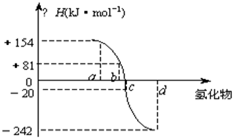 已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).下图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).下图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:(1)写出氧族元素中含有18e-的两种氢化物的电子式


(2)请你归纳:非金属元素氢化物的稳定性与氢化物的生成热△H的关系
非金属元素氢化物越稳定,△H越小,反之亦然
非金属元素氢化物越稳定,△H越小,反之亦然
(3)写出硫化氢在热力学标准态下,发生分解反应的热化学反应方程式:
H2S(g)=S(s)+H2(g);△H=+20kJ/mol
H2S(g)=S(s)+H2(g);△H=+20kJ/mol
.(2009?梅州模拟)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol?L-1、0.001mol?L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol?L-1)的用量均为2mL.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
计算用0.001mol?L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?
查看习题详情和答案>>
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和 ③ ③ 探究温度对该反应速率的影响;(Ⅲ)实验①和 ④ ④ 探究催化剂对该反应速率的影响;) |
| ② | 298 298 |
0.5 0.5 |
0.001 0.001 | |
| ③ | 323K 323K |
0.5 0.5 |
0.01 0.01 | |
| ④ | 298 298 |
0 0 |
0.01 0.01 |
| KMnO4酸性溶液 的浓度/mol?L-1 |
溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
1×10-4mol?L-1?min-1
1×10-4mol?L-1?min-1
(忽略混合前后溶液的体积变化,写出计算过程).(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?
不可行
不可行
.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.(3分)
取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.(3分)
.在298K、1.01×105Pa,将22gCO2通入1.0mol?L-1NaOH溶液0.75L中充分反应,测得反应放出热量为akJ.已知该条件下1molCO2通入2.0mol?L-1NaOH溶液1L中充分反应放出的热量为bkJ.则CO2与NaOH反应生成NaHCO3的热化学方程式正确的是( )
查看习题详情和答案>>
(2013?绍兴二模)二甲醚(DME)以其优良的性质,被称为21世纪的新型“清洁能源”,近年来,二甲醚最为直接的应用是替代液化气作民用燃料以及代替柴油作汽车燃料.二甲醚的生产方法也在不断的研究中,现在主要有以下两种生产方法.
方法一(液相两步法):第一步 CO+2H2?CH3OH 第二步 2CH3OH?CH3OCH3+H2O
方法二(液相一步法):将甲醇的合成和脱水两个反应组合在一个反应器中进行3CO+3H2?CH3OCH3+CO2
(1)液相一步法实际是两步法两个反应的组合,其选用的催化剂应该具有
CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-49.01kJ?mol-1…①
2CH3OH(l)?CH3OCH3(g)+H2O(l)△H=-24.02kJ?mol-1…②
CO2(g)+H2(g)?CO(g)+H2O(l)△H=41.17kJ?mol-1…③
(2)CO2加氢一步法与液相一步法相比有何优点
(3)写出CO2加氢一步法在298K下总反应的热化学方程式
有人对甲醇脱水转化为甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得以下2组图.
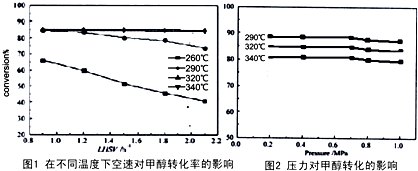
(4)根据以上两幅图选择不受空速影响的合适反应温度和压强
(5)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)?CH3OCH3(g)+H2O(g),测得有关数据如下:
则此反应在该温度下的平衡常数为
(6)根据文献,甲醇转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇),若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率ΧM=
查看习题详情和答案>>
方法一(液相两步法):第一步 CO+2H2?CH3OH 第二步 2CH3OH?CH3OCH3+H2O
方法二(液相一步法):将甲醇的合成和脱水两个反应组合在一个反应器中进行3CO+3H2?CH3OCH3+CO2
(1)液相一步法实际是两步法两个反应的组合,其选用的催化剂应该具有
既有甲醇合成催化的功能,又有甲醇脱水催化的功能,是一种双功能的复合催化剂
既有甲醇合成催化的功能,又有甲醇脱水催化的功能,是一种双功能的复合催化剂
.目前一种更新的方法--CO2加氢一步法取得了较大进展,其反应为:2CO2+6H2?2CH3OCH3+3H2O 该方法包括甲醇的合成、甲醇的脱水和水气的逆转换反应,其方程式如下(298K):CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-49.01kJ?mol-1…①
2CH3OH(l)?CH3OCH3(g)+H2O(l)△H=-24.02kJ?mol-1…②
CO2(g)+H2(g)?CO(g)+H2O(l)△H=41.17kJ?mol-1…③
(2)CO2加氢一步法与液相一步法相比有何优点
原料廉价,能减少环境污染等
原料廉价,能减少环境污染等
.(3)写出CO2加氢一步法在298K下总反应的热化学方程式
2CO2(g)+6H2(g)?2CH3OCH3(g)+3H2O(l)△H=-122.04 kJ?mol-1
2CO2(g)+6H2(g)?2CH3OCH3(g)+3H2O(l)△H=-122.04 kJ?mol-1
.有人对甲醇脱水转化为甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得以下2组图.

(4)根据以上两幅图选择不受空速影响的合适反应温度和压强
320℃、0.2-0.6Mpa
320℃、0.2-0.6Mpa
.(5)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)?CH3OCH3(g)+H2O(g),测得有关数据如下:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| c(CH3OH)/mol?L-1 | 0.51 | 0.2 | 0.1 | 0.01 | 0.01 |
625
625
,若再向容器分别加入甲醇0.02mol、CH3OCH31.0mol,此时该反应v正反应>
>
v逆反应(填“>”、“<”或“=”).(6)根据文献,甲醇转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇),若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率ΧM=
XM=
或
| ||||
|
| 32Cw |
| 32Cw+9CM) |
XM=
或
.
| ||||
|
| 32Cw |
| 32Cw+9CM) |