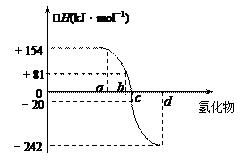题目内容
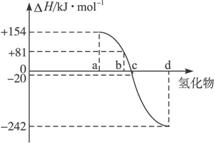
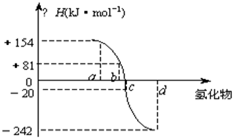 已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).下图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).下图为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:(1)写出氧族元素中含有18e-的两种氢化物的电子式


(2)请你归纳:非金属元素氢化物的稳定性与氢化物的生成热△H的关系
非金属元素氢化物越稳定,△H越小,反之亦然
非金属元素氢化物越稳定,△H越小,反之亦然
(3)写出硫化氢在热力学标准态下,发生分解反应的热化学反应方程式:
H2S(g)=S(s)+H2(g);△H=+20kJ/mol
H2S(g)=S(s)+H2(g);△H=+20kJ/mol
.分析:(1)氧族元素有O、S等元素,含有18e-的物质的有H2O2、H2S等物质;
(2)根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,以此进行判断;
(3)根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
(2)根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,以此进行判断;
(3)根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
解答:(1)氧族元素有O、S等元素,含有18e-的物质的有H2O2、H2S等物质,电子式分别为: ,
,
故答案为: ;
;
(2)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O.
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
(3)由(2)可知,c为硫化氢的生成热数据,则硫化氢分解吸热,且△H=+20kJ/mol,
所以H2S发生分解反应的热化学反应方程式为H2S(g)=S(s)+H2(g);△H=+20kJ/mol,
故答案为:H2S(g)=S(s)+H2(g);△H=+20kJ/mol.
 ,
,故答案为:
 ;
;(2)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O.
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
(3)由(2)可知,c为硫化氢的生成热数据,则硫化氢分解吸热,且△H=+20kJ/mol,
所以H2S发生分解反应的热化学反应方程式为H2S(g)=S(s)+H2(g);△H=+20kJ/mol,
故答案为:H2S(g)=S(s)+H2(g);△H=+20kJ/mol.
点评:本题考查化学反应与能量变化,题目难度不大,本题注意从图象判断各种氢化物的种类为解答该题的关键.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
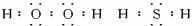
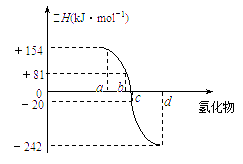 已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题: