题目内容
(2013?绍兴二模)二甲醚(DME)以其优良的性质,被称为21世纪的新型“清洁能源”,近年来,二甲醚最为直接的应用是替代液化气作民用燃料以及代替柴油作汽车燃料.二甲醚的生产方法也在不断的研究中,现在主要有以下两种生产方法.
方法一(液相两步法):第一步 CO+2H2?CH3OH 第二步 2CH3OH?CH3OCH3+H2O
方法二(液相一步法):将甲醇的合成和脱水两个反应组合在一个反应器中进行3CO+3H2?CH3OCH3+CO2
(1)液相一步法实际是两步法两个反应的组合,其选用的催化剂应该具有
CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-49.01kJ?mol-1…①
2CH3OH(l)?CH3OCH3(g)+H2O(l)△H=-24.02kJ?mol-1…②
CO2(g)+H2(g)?CO(g)+H2O(l)△H=41.17kJ?mol-1…③
(2)CO2加氢一步法与液相一步法相比有何优点
(3)写出CO2加氢一步法在298K下总反应的热化学方程式
有人对甲醇脱水转化为甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得以下2组图.
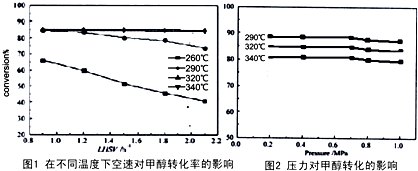
(4)根据以上两幅图选择不受空速影响的合适反应温度和压强
(5)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)?CH3OCH3(g)+H2O(g),测得有关数据如下:
则此反应在该温度下的平衡常数为
(6)根据文献,甲醇转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇),若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率ΧM=
方法一(液相两步法):第一步 CO+2H2?CH3OH 第二步 2CH3OH?CH3OCH3+H2O
方法二(液相一步法):将甲醇的合成和脱水两个反应组合在一个反应器中进行3CO+3H2?CH3OCH3+CO2
(1)液相一步法实际是两步法两个反应的组合,其选用的催化剂应该具有
既有甲醇合成催化的功能,又有甲醇脱水催化的功能,是一种双功能的复合催化剂
既有甲醇合成催化的功能,又有甲醇脱水催化的功能,是一种双功能的复合催化剂
.目前一种更新的方法--CO2加氢一步法取得了较大进展,其反应为:2CO2+6H2?2CH3OCH3+3H2O 该方法包括甲醇的合成、甲醇的脱水和水气的逆转换反应,其方程式如下(298K):CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-49.01kJ?mol-1…①
2CH3OH(l)?CH3OCH3(g)+H2O(l)△H=-24.02kJ?mol-1…②
CO2(g)+H2(g)?CO(g)+H2O(l)△H=41.17kJ?mol-1…③
(2)CO2加氢一步法与液相一步法相比有何优点
原料廉价,能减少环境污染等
原料廉价,能减少环境污染等
.(3)写出CO2加氢一步法在298K下总反应的热化学方程式
2CO2(g)+6H2(g)?2CH3OCH3(g)+3H2O(l)△H=-122.04 kJ?mol-1
2CO2(g)+6H2(g)?2CH3OCH3(g)+3H2O(l)△H=-122.04 kJ?mol-1
.有人对甲醇脱水转化为甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得以下2组图.

(4)根据以上两幅图选择不受空速影响的合适反应温度和压强
320℃、0.2-0.6Mpa
320℃、0.2-0.6Mpa
.(5)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)?CH3OCH3(g)+H2O(g),测得有关数据如下:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| c(CH3OH)/mol?L-1 | 0.51 | 0.2 | 0.1 | 0.01 | 0.01 |
625
625
,若再向容器分别加入甲醇0.02mol、CH3OCH31.0mol,此时该反应v正反应>
>
v逆反应(填“>”、“<”或“=”).(6)根据文献,甲醇转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇),若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率ΧM=
XM=
或
| ||||
|
| 32Cw |
| 32Cw+9CM) |
XM=
或
.
| ||||
|
| 32Cw |
| 32Cw+9CM) |
分析:(1)根据方法1可知,生成二甲醚需要一氧化碳与氢气合成甲醇,然后甲醇脱水生成二甲醚,所以方法2使用的催化剂必须具有这两方面功能;
(2)通过对比CO2加氢一步法与液相一步法的反应原理找出优点;
(3)利用盖斯定律根据热化学方程式①×2+②得出CO2加氢一步法在298K下总反应的热化学方程式;
(4)分析图1、图2,找出不受空速影响的合适反应温度和压强;
(5)根据表中数据,3分钟后达到平衡状态,计算出该反应的平衡常数;向容器分别加入甲醇0.02mol、CH3OCH31.0mol,重新计算出浓度商,与化学平衡常数对比,判断平衡移动方向;
(6)可以设出冷凝液总质量为mg,然后列式计算出甲醇的转化率.
(2)通过对比CO2加氢一步法与液相一步法的反应原理找出优点;
(3)利用盖斯定律根据热化学方程式①×2+②得出CO2加氢一步法在298K下总反应的热化学方程式;
(4)分析图1、图2,找出不受空速影响的合适反应温度和压强;
(5)根据表中数据,3分钟后达到平衡状态,计算出该反应的平衡常数;向容器分别加入甲醇0.02mol、CH3OCH31.0mol,重新计算出浓度商,与化学平衡常数对比,判断平衡移动方向;
(6)可以设出冷凝液总质量为mg,然后列式计算出甲醇的转化率.
解答:解:(1)由方法1可知,生成二甲醚需要一氧化碳与氢气合成甲醇,然后甲醇脱水生成二甲醚,所以方法2使用的催化剂必须具有这两方面功能的复合催化剂,
故答案为:既有甲醇合成催化的功能,又有甲醇脱水催化的功能,是一种双功能的复合催化剂;
(2)通过反应原理可以看出,CO2加氢一步法原料是二氧化碳,原料廉价,产物是二甲醚和水,产物减少了环境污染,
故答案为:原料廉价,能减少环境污染等;
(3)根据盖斯定律及热化学方程式:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-49.01kJ?mol-1…①
2CH3OH(l)?CH3OCH3(g)+H2O(l)△H=-24.02kJ?mol-1…②
①×2+②可得热化学方程式为:2CO2(g)+6H2(g)?2CH3OCH3(g)+3H2O(l)△H=-122.04 kJ?mol-1,
故答案为:2CO2(g)+6H2(g)?2CH3OCH3(g)+3H2O(l)△H=-122.04 kJ?mol-1;
(4)根据图1、图2可知,不受空速影响的合适反应温度为320℃、压强在0.2-0.6Mpa,
故答案为:320℃、0.2-0.6Mpa;
(5)根据反应方程式:2CH3OH(g)?CH3OCH3(g)+H2O(g),
反应前c(CH3OH)/mol?L-1:0.51 0 0
3分钟后达到平衡状态浓度:0.01 0.25 0.25
平衡常数为:
=625,
再向容器分别加入甲醇0.02mol、CH3OCH31.0mol反应的浓度商为:
≈347.2<625,平衡向着正向移动,正反应速率大于逆反应速率,
故答案为:625;>;
(6)设冷凝液总质量为mg,水的物质的量为:
mol,甲醇的物质的量为:
mol,
根据反应2CH3OH(g)?CH3OCH3(g)+H2O(g)可知,生成
mol水,需要消耗甲醇的物质的量为:2×
mol,
甲醇的质量为:XM=
=
,
故答案为:XM=
或
.
故答案为:既有甲醇合成催化的功能,又有甲醇脱水催化的功能,是一种双功能的复合催化剂;
(2)通过反应原理可以看出,CO2加氢一步法原料是二氧化碳,原料廉价,产物是二甲醚和水,产物减少了环境污染,
故答案为:原料廉价,能减少环境污染等;
(3)根据盖斯定律及热化学方程式:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-49.01kJ?mol-1…①
2CH3OH(l)?CH3OCH3(g)+H2O(l)△H=-24.02kJ?mol-1…②
①×2+②可得热化学方程式为:2CO2(g)+6H2(g)?2CH3OCH3(g)+3H2O(l)△H=-122.04 kJ?mol-1,
故答案为:2CO2(g)+6H2(g)?2CH3OCH3(g)+3H2O(l)△H=-122.04 kJ?mol-1;
(4)根据图1、图2可知,不受空速影响的合适反应温度为320℃、压强在0.2-0.6Mpa,
故答案为:320℃、0.2-0.6Mpa;
(5)根据反应方程式:2CH3OH(g)?CH3OCH3(g)+H2O(g),
反应前c(CH3OH)/mol?L-1:0.51 0 0
3分钟后达到平衡状态浓度:0.01 0.25 0.25
平衡常数为:
| 0.25×0.25 |
| (0.01)2 |
再向容器分别加入甲醇0.02mol、CH3OCH31.0mol反应的浓度商为:
| (1.0+0.25)×0.25 |
| (0.03)2 |
故答案为:625;>;
(6)设冷凝液总质量为mg,水的物质的量为:
| m?CW |
| 18 |
| m?CM |
| 32 |
根据反应2CH3OH(g)?CH3OCH3(g)+H2O(g)可知,生成
| m?CW |
| 18 |
| m?CW |
| 18 |
甲醇的质量为:XM=
| ||||
|
| 32Cw |
| 32Cw+9CM) |
故答案为:XM=
| ||||
|
| 32Cw |
| 32Cw+9CM) |
点评:本题借助二甲醚的制取,考查了化学方案的评价、转化率计算、应用盖斯定律书写热化学方程式等知识,题目比较综合,充分考查学生的分析、理解能力,难度稍大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目