摘要:2.[江苏省前中国际分校2009届高三第一学期第一次调研试卷]已知下列反应的热化学方程式为: ⑴C(s)+O2(g)=CO2(g) ΔH 1=-393.5kJ/mol ⑵CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH 2=-870.3kJ/mol ⑶H2(g)+O2(g)=H2O(l) ΔH 3=-285.8kJ/mol 2C(s)+2H2(g)+O2(g)=CH3COOH为 A.488.3 kJ/mol B.-488.3 kJ/mol C.-244.15 kJ/mol D.244.15 kJ/mol [解析]: 2C(s)+2O2(g)=2CO2(g) ΔH 1=-787.0kJ/mol 2CO2(g)+2H2O(l)=CH3COOH(l)+2O2(g)ΔH 2=+870.3kJ/mol 2H2(g)+O2(g)=2H2O(l) ΔH 3=-571.6kJ/mol 上述三个热化学方程式加和得2C(s)+2H2(g)+O2(g)=CH3COOH(l).ΔH 1=-488.3 kJ/mol [答案]:B
网址:http://m.1010jiajiao.com/timu3_id_54216[举报]
 如图所示的实验装置可用来测定含两种元素的某种气体x的分子式.在注射器A中装有240mL气体X慢慢通过 不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集的无色液体是水;在注射器D中收集的气体是氮气.试回答下列问题:
如图所示的实验装置可用来测定含两种元素的某种气体x的分子式.在注射器A中装有240mL气体X慢慢通过 不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集的无色液体是水;在注射器D中收集的气体是氮气.试回答下列问题:(1)X气体是由
N
N
和H
H
元素组成的.(2)若240mLX气体完全反应后,收集到氮气的质量是0.28g.根据实验时的温度和压强计算1molX的气体的体积是24000mL,则X的摩尔质量是
32
32
g/mol.(3)通过计算,确定x的分子式为
N2H4
N2H4
.(4)写出B中发生反应的化学方程式(x在该条件下不发生分解反应)
2CuO+N2H4
2Cu+2H2O+N2
| ||
2CuO+N2H4
2Cu+2H2O+N2
.
| ||
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:(1)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2.
①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),求该矿石含铜的质量分数.
②现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:称取研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100mL滴有淀粉的蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体积为20.00mL.求该黄铜矿的纯度.
(2)将FeS和Fe2O3的混和物56.6g,用足量稀H2SO4溶解后可得3.2g硫,求原混和物中FeS的质量.
(3)一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收.利用下图装置加热无水硫酸铜粉末直至完全分解.若无水硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如下表所示.
| 装置 | A (试管+粉末) |
B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
(4)硫化钠是用于皮革的重要化学试剂,可用无水Na2SO4与炭粉在高温下反应制得,化学方程式如下:
①Na2SO4+4C
| 高温 |
| 高温 |
①若在反应过程中,产生CO和CO2混合气体为2mol,求生成Na2S的物质的量.
②硫化钠晶体放置在空气中,会缓慢氧化成Na2SO3,甚至是Na2SO4,现将43.72g部分变质的硫化钠样品溶于水中,加入足量盐酸后,过滤得4.8g沉淀和1.12L H2S 气体(标准状况,假设溶液中气体全部逸出),在滤液中加入足量的BaCl2后过滤得2.33g沉淀,分析该硫化钠样品的成分及其物质的量.
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.维生素C易被空气中的氧气氧化.在新鲜的水果,蔬菜,乳制品中都富含有维生素C,如新鲜橙汁中维生素C的含量为500mg?L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量,下面是测定分析的实验报告:
(1)测定目的:测定XX牌软包装橙汁中维生素C的含量.
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-.
(3)实验用品:
①实验仪器:酸式滴定管,铁架台,锥形瓶,滴管等.
②试剂:指示剂
(4)实验步骤:
①洗涤仪器:检查滴定管是否漏水,润洗好后装好标准碘液.
②打开软包装橙汁,目测颜色(橙黄色,澄清度好),用酸式滴定管向锥形瓶中移入20.00ml待测橙汁,滴入2滴指示剂.
用左手控制滴定管的
③记下读数,再重复操作两次.
(5)数据记录处理,若经数据处理,滴定中消耗标准碘溶液的体积是15.00ml,则此橙汁中维生素C的含量为
(6)误差分析:若在实验中存在下列操作,其中会使维生素C的含量偏低的是
A.量取待测橙汁的仪器水洗后未润洗
B.锥形瓶水洗后未用待测液润洗
C.滴定前尖嘴部分有一气泡,滴定终点时消失
D.滴定前仰视读数,滴定后俯视读数.
查看习题详情和答案>>
(1)测定目的:测定XX牌软包装橙汁中维生素C的含量.
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-.
(3)实验用品:
①实验仪器:酸式滴定管,铁架台,锥形瓶,滴管等.
②试剂:指示剂
淀粉
淀粉
(填名称),7.5×10-3mol?L-1标准碘液,蒸馏水.(4)实验步骤:
①洗涤仪器:检查滴定管是否漏水,润洗好后装好标准碘液.
②打开软包装橙汁,目测颜色(橙黄色,澄清度好),用酸式滴定管向锥形瓶中移入20.00ml待测橙汁,滴入2滴指示剂.
用左手控制滴定管的
活塞
活塞
(填部位),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化直到滴定终点,判断滴定终点的现象是最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色
最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色
.③记下读数,再重复操作两次.
(5)数据记录处理,若经数据处理,滴定中消耗标准碘溶液的体积是15.00ml,则此橙汁中维生素C的含量为
990
990
mg?L-1.(6)误差分析:若在实验中存在下列操作,其中会使维生素C的含量偏低的是
AD
AD
A.量取待测橙汁的仪器水洗后未润洗
B.锥形瓶水洗后未用待测液润洗
C.滴定前尖嘴部分有一气泡,滴定终点时消失
D.滴定前仰视读数,滴定后俯视读数.
酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.回答下列问题:
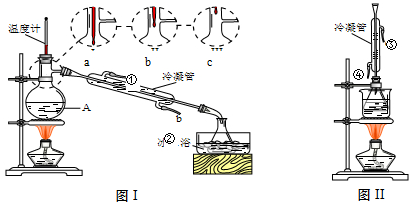
(1)米酒中乙醇含量可采用蒸馏法测定,装置如图Ⅰ所示.仪器A的名称是 ;A中温度计的位置正确的是 (选填a、b或c);
(2)收集乙醇的锥形瓶需置于冰水浴中,其目的是 .欲收集无水乙醇,可加入足量的 (填物质名称)后再进行蒸馏.
(3)为测定某白酒样品的总酸量,取20.00mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010mol/L的NaOH标准溶液滴定至终点.判断终点的依据是 .若该白酒样品为优质级,则消耗NaOH溶液体积应不小于 mL.
(4)白酒中的总酯量可用返滴法测定.往上题滴定后的溶液(恰好至终点)中再加入20.00mL 0.100mol/L NaOH标准溶液,用图Ⅱ装置水浴加热半小时.冷却后用0.100mol/L的硫酸标准溶液滴定至终点.加热半小时的目的是 .已知最终消耗硫酸标准溶液7.70mL,该白酒样品中总酯量为 g/L.
(5)下列操作会使总酯量测定结果偏高的是 (选填编号)
a.加热时未使用水浴和冷凝管
b.选用了甲基橙为指示剂
c.滴定前滴定管内无气泡,滴定后产生气泡
d.滴定管未用硫酸标准溶液润洗
(6)图Ⅰ和图Ⅱ的装置中均用到了冷凝管,其进水口分别为 (选填编号)
a.①③b.②④c.②③d.①④ 查看习题详情和答案>>

(1)米酒中乙醇含量可采用蒸馏法测定,装置如图Ⅰ所示.仪器A的名称是
(2)收集乙醇的锥形瓶需置于冰水浴中,其目的是
(3)为测定某白酒样品的总酸量,取20.00mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010mol/L的NaOH标准溶液滴定至终点.判断终点的依据是
(4)白酒中的总酯量可用返滴法测定.往上题滴定后的溶液(恰好至终点)中再加入20.00mL 0.100mol/L NaOH标准溶液,用图Ⅱ装置水浴加热半小时.冷却后用0.100mol/L的硫酸标准溶液滴定至终点.加热半小时的目的是
(5)下列操作会使总酯量测定结果偏高的是
a.加热时未使用水浴和冷凝管
b.选用了甲基橙为指示剂
c.滴定前滴定管内无气泡,滴定后产生气泡
d.滴定管未用硫酸标准溶液润洗
(6)图Ⅰ和图Ⅱ的装置中均用到了冷凝管,其进水口分别为
a.①③b.②④c.②③d.①④ 查看习题详情和答案>>
 维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.维生素C易被空气中的氧气氧化.在新鲜的水果,蔬菜,乳制品中都富含有维生素C,如新鲜橙汁中维生素C的含量为500mg?L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量,下面是测定分析的实验报告:
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.维生素C易被空气中的氧气氧化.在新鲜的水果,蔬菜,乳制品中都富含有维生素C,如新鲜橙汁中维生素C的含量为500mg?L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量,下面是测定分析的实验报告:(1)测定目的:测定XX牌软包装橙汁中维生素C的含量.
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-.
(3)实验用品:
①实验仪器:酸式滴定管,铁架台,锥形瓶,滴管等.
②试剂:指示剂
(4)实验步骤:
①洗涤仪器:检查滴定管是否漏水,润洗好后装好标准碘液.
②打开软包装橙汁,目测颜色(橙黄色,澄清度好),用
③用左手控制滴定管的
④记下读数,再重复操作两次.
(5)数据记录处理,若经数据处理,滴定中消耗标准碘溶液的体积是15.00ml,则此橙汁中维生素C的含量为
(6)误差分析:若在实验中存在下列操作,其中会使维生素C的含量偏低的是
A量取待测橙汁的仪器水洗后未润洗
B锥形瓶水洗后未用待测液润洗
C滴定前尖嘴部分有一气泡,滴定终点时消失
D滴定前仰视读数,滴定后俯视读数
E在滴定过程中剧烈震荡锥形瓶.