摘要:磷在氧气中燃烧.可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧.至反应物耗尽.并放出X KJ热量. ⑴ 通过计算确定反应产物的组成是 .其相应的 质量(g)为 . ⑵ 已知单质磷的燃烧热为Y KJ/mol.则1mol P与O2反应生成固态P2O3 的反应热 △H = . ⑶ 写出1mol P与O2反应生成固态P2O3 的热化学反应方程式: . [解析]:(1) 4P + 3O2 = 2P2O3 , 4 P + 5O2 = 2P2O5 n(P)=0.1mol,n(O2)=0.1MOL,若只生成P2O3 .消耗O2 3/4mol,若为P2O5消耗O2 5/4moL.所以产物是P2O3 和P2O5.根据原子守恒,2n(P2O3)+2n(P2O5)=0.1mol, 3n(P2O3)+5n(P2O5)=0.2mol. n(P2O3) =0.025mol , n(P2O5)= 0.025mol m(P2O3) =2.75g , m(P2O5) =3.55g (2) |△H|×0.05mol+0.05mol×Y KJ/mol=XKJ , |△H|= KJ/mol, △H= - KJ/mol, + 3/4O2(g) == 1/2 P2O3 KJ/mol [答案]:⑴ P2O3 P2O5
网址:http://m.1010jiajiao.com/timu3_id_54212[举报]
磷在氧气中燃烧,可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出X KJ热量.
(1)通过计算确定反应产物的组成(用化学式表示)是
(2)已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O3的热化学反应方程式:
查看习题详情和答案>>
(1)通过计算确定反应产物的组成(用化学式表示)是
P2O3、P2O5
P2O3、P2O5
.(2)已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O3的热化学反应方程式:
P(s)+
O2(g)=
P2O3(s)△H=-(20X-Y)KJ/mol
| 3 |
| 4 |
| 1 |
| 2 |
P(s)+
O2(g)=
P2O3(s)△H=-(20X-Y)KJ/mol
.| 3 |
| 4 |
| 1 |
| 2 |
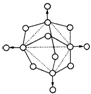 磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)
磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)(1)由右图可知,X的分子式为
(2)X分子内的磷原子所形成的空间几何形状是
(3)X分子中共含有P-O-P键
(4)磷在氧气中燃烧,可能生成两种固态氧化物.31g的单质磷(P)在32g氧气中燃烧,至反应物耗尽,放出a kJ热量.已知单质磷(P)的燃烧热为b kJ/mol,则1mol P与O2反应生成固态P2O3放出
磷在氧气中燃烧,可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出XkJ热量.
(1)通过计算确定反应产物的组成(用化学式表示)是
(2)已知单质磷的燃烧热为YkJ/mol,则1mol P与O2反应生成固态P2O3的反应热△H=
(3)写出1molP与O2反应生成固态P2O3的热化学方程式:
查看习题详情和答案>>
(1)通过计算确定反应产物的组成(用化学式表示)是
P2O3、P2O5
P2O3、P2O5
,其相应质量(g)为2.75、3.55
2.75、3.55
.(2)已知单质磷的燃烧热为YkJ/mol,则1mol P与O2反应生成固态P2O3的反应热△H=
-(20X-Y)kJ/mol
-(20X-Y)kJ/mol
.(3)写出1molP与O2反应生成固态P2O3的热化学方程式:
P(s)+
O2(g)=
P2O3(s)△H=-(20X-Y)kJ/mol
| 3 |
| 4 |
| 1 |
| 2 |
P(s)+
O2(g)=
P2O3(s)△H=-(20X-Y)kJ/mol
.| 3 |
| 4 |
| 1 |
| 2 |