题目内容
磷在氧气中燃烧,可能生成两种固态氧化物.3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出X KJ热量.
(1)通过计算确定反应产物的组成(用化学式表示)是
(2)已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O3的热化学反应方程式:
(1)通过计算确定反应产物的组成(用化学式表示)是
P2O3、P2O5
P2O3、P2O5
.(2)已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O3的热化学反应方程式:
P(s)+
O2(g)=
P2O3(s)△H=-(20X-Y)KJ/mol
| 3 |
| 4 |
| 1 |
| 2 |
P(s)+
O2(g)=
P2O3(s)△H=-(20X-Y)KJ/mol
.| 3 |
| 4 |
| 1 |
| 2 |
分析:(1)根据氧化还原反应中得失电子数相等判断其产物;
(2)先写出磷的燃烧热化学反应方程式和.1g的单质磷(P)在3.2g的氧气中燃烧的热化学反应方程式,将方程式进行整理得出磷燃烧生成三氧化二磷的热化学反应方程式,其焓变相应改变.
(2)先写出磷的燃烧热化学反应方程式和.1g的单质磷(P)在3.2g的氧气中燃烧的热化学反应方程式,将方程式进行整理得出磷燃烧生成三氧化二磷的热化学反应方程式,其焓变相应改变.
解答:解:(1)磷在氧气中燃烧是氧化还原反应,3.2g氧气参加反应得到电子的物质的量=
×4=0.4mol;
假设生成的固体是三氧化二磷,磷失去电子的物质的量=
×3=0.3mol,得失电子数不相等,所以该固体不是纯净的三氧化二磷;
假设生成的固体是五氧化二磷,磷失去电子的物质的量=
×5=0.5mol,得失电子数不相等,所以该固体不是纯净的三氧化二磷;
失去的电子数应该在二者之间,所以生成的固体是两种固体的混合物,即P2O3、P2O5,
故答案为:P2O3、P2O5;
(2)磷燃烧的热化学方程式为:P(s)+
O2(g)=
P2O5 (s)△H=-Y KJ/mol①,
3.1g的单质磷(P)在3.2g的氧气中燃烧生成三氧化二磷和五氧化二磷的热化学反应方程式为:
4P(s)+4O2(g)=P2O5(s)+P2O3(s)△H=-40X KJ/mol②,
将方程式
得P(s)+
O2(g)=
P2O3(s)△H=-(20X-Y)KJ/mol,
故答案为:P(s)+
O2(g)=
P2O3(s)△H=-(20X-Y)KJ/mol.
| 3.2g |
| 32g/mol |
假设生成的固体是三氧化二磷,磷失去电子的物质的量=
| 3.1g |
| 31g/mol |
假设生成的固体是五氧化二磷,磷失去电子的物质的量=
| 3.1g |
| 31g/mol |
失去的电子数应该在二者之间,所以生成的固体是两种固体的混合物,即P2O3、P2O5,
故答案为:P2O3、P2O5;
(2)磷燃烧的热化学方程式为:P(s)+
| 5 |
| 4 |
| 1 |
| 2 |
3.1g的单质磷(P)在3.2g的氧气中燃烧生成三氧化二磷和五氧化二磷的热化学反应方程式为:
4P(s)+4O2(g)=P2O5(s)+P2O3(s)△H=-40X KJ/mol②,
将方程式
| ②-①×2 |
| 2 |
| 3 |
| 4 |
| 1 |
| 2 |
故答案为:P(s)+
| 3 |
| 4 |
| 1 |
| 2 |
点评:本题考查了磷燃烧产物的判断及热化学方程式的书写,难度不大,运用盖斯定律进行简单计算是高考的热点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
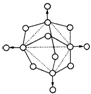 磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)
磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)