网址:http://m.1010jiajiao.com/timu3_id_54194[举报]
 《物质结构与性质》
《物质结构与性质》从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.
(1)下列说法正确的是
A.元素电负性由大到小的顺序为F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为
(3)Cu 2+基态的电子排布式为

从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.

(1)下列说法正确的是 (填字母).
A.元素电负性由大到小的顺序为F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为 .光气(COCl2)各原子最外层都满足8电子稳定结构,COCl2分子空间构型为 (用文字描述).
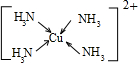
(3)Cu 2+基态的电子排布式为 .向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为 ,不考虑空间构型,其内界结构可用示意图表示为 .
查看习题详情和答案>>
从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质。

(1)下列说法正确的是 (填序号)。
A.元素电负性由大到小的顺序为:F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为:Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式应为 。光气(COC12)分子内各原子最外层都满足8电子稳定结构,则光气分子的空间构型为 (用文字描述)。
(3)Cu2+基态电子排布式为 。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为 ,若不考虑空间构型,其内界结构可用示意图表示为 。
查看习题详情和答案>>
 (08广东实验中学三模)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题
(08广东实验中学三模)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题
(1)下列说法正确的是 (选填序号)。
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷和镓都属于p区元素
E.半导体GaP、SiC与砷化镓为等电子体
(2)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到, 该反应在700℃进行,反应的方程式为: 。
AsH3空间形状为: (CH3)3Ga中碳镓键之间的键角为: 。
(3)Ga的核外电子排布式为: 。
(4)AsH3沸点比NH3低,其原因是: 。
(5)请预测AsH3的两种化学性质:
查看习题详情和答案>>(1)镍氢碱性充电电池被誉为“绿色化学电源”,放、充电时的反应:2NiOOH+H2
| 充电 |
| 放电 |
(2)氨在空气中燃烧,生成水和氮气.已知:
N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1
2H2(g)+O2(g)=2H2O(l);△H=-572kJ?mol-1
则氨在空气中燃烧生成液态水和氮气时的热化学方程为:
(3)研究表明工业上合成氨反应 (N2+3H2
| ||
| 高温高压 |
①合成氨是
②合成氨选择400~500℃的原因是:
③在容积固定的密闭容器中发生上述反应,下表中为各物质在不同时刻的浓度.
| 时间/min | c(N2)/mol?L-1 | c(H2)/mol?L-1 | c(NH3)/mol?L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
a.使用催化剂 b.降低温度 c.增加氢气的浓度 d.分离出NH3
(4)在-50℃时,液氨中存在电离平衡NH3(l)?NH4++NH2-,离子积常数
K=c(NH4+)?c(NH2-).若一定条件下,平衡时c(NH2-)=1×10-15mol?L-1,
下列说法正确的是:
a.在液氨中加入NaNH2,液氨的离子积常数增大
b.此温度下液氨的离子积常数为1×10-30
c.液氨在-50℃的电离程度比常温下纯水的大.