摘要:22.若双曲线以为渐近线.(0.2)为焦点.则此双曲线方程为 .
网址:http://m.1010jiajiao.com/timu3_id_54083[举报]
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.
(1)钒主要用来制造钒钢.钒钢具有很高的耐磨损性和抗撞击性,原因是 (填序号)
A.钒在常温下,化学活泼性较弱
B.钒钢表面形成了致密且坚固的氧化膜
C.钒钢结构紧密,具有较高的韧性、弹性和强度
(2)在温度较低时,溶液中钒酸盐会转化为焦钒酸盐:
2VO43-+H2O?V2O74-+2OH-①
在温度较高时,焦钒酸盐又转化为偏钒酸盐:
V2O74-+H2O?2VO3-+2OH-②
反应②平衡常数的表达式K= ;
(3)已知某温度下:4V(s)+5O2(g)=2V2O5(s)△H=-1551kJ?mol-1
4V(s)+3O2(g)=2V2O3(s)△H=-1219kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
写出H2还原V2O5得到V2O3的热化学方程式: ;
(4)用钒酸钠(Na3VO4)溶液(含PO43-、SiO32-等杂质离子)制备高纯V2O5流程如下: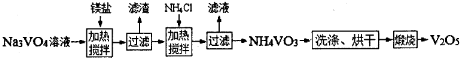
①加入镁盐,加热搅拌,其中加热的作用是 ;
②在25℃时,Ksp[Mg3(PO4)2]=1.0×10-26,若净化后溶液中的Mg2+的平衡浓度为 1.0×10-4 mol?L-1,则溶液中c(P043-)= ;
③加入NH4Cl,加热搅拌,该步骤反应的离子方程式为 ;
④为测定产品纯度,称取产品mg,溶解后定容在100mL容量瓶中,每次取5.00mL溶液于锥形瓶中,加入一定量的稀盐酸和KI溶液,用a mol?L-1Na2S2O3标准溶 液滴定,发生的反应为:
V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O
I2+2Na2S2O3=Na2S4O6+2NaI
若三次滴定消耗标准溶液的平均体积为bmL,则该产品的纯度为 (用含m、a、b的代数式表示).
查看习题详情和答案>>
(1)钒主要用来制造钒钢.钒钢具有很高的耐磨损性和抗撞击性,原因是
A.钒在常温下,化学活泼性较弱
B.钒钢表面形成了致密且坚固的氧化膜
C.钒钢结构紧密,具有较高的韧性、弹性和强度
(2)在温度较低时,溶液中钒酸盐会转化为焦钒酸盐:
2VO43-+H2O?V2O74-+2OH-①
在温度较高时,焦钒酸盐又转化为偏钒酸盐:
V2O74-+H2O?2VO3-+2OH-②
反应②平衡常数的表达式K=
(3)已知某温度下:4V(s)+5O2(g)=2V2O5(s)△H=-1551kJ?mol-1
4V(s)+3O2(g)=2V2O3(s)△H=-1219kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
写出H2还原V2O5得到V2O3的热化学方程式:
(4)用钒酸钠(Na3VO4)溶液(含PO43-、SiO32-等杂质离子)制备高纯V2O5流程如下:

①加入镁盐,加热搅拌,其中加热的作用是
②在25℃时,Ksp[Mg3(PO4)2]=1.0×10-26,若净化后溶液中的Mg2+的平衡浓度为 1.0×10-4 mol?L-1,则溶液中c(P043-)=
③加入NH4Cl,加热搅拌,该步骤反应的离子方程式为
④为测定产品纯度,称取产品mg,溶解后定容在100mL容量瓶中,每次取5.00mL溶液于锥形瓶中,加入一定量的稀盐酸和KI溶液,用a mol?L-1Na2S2O3标准溶 液滴定,发生的反应为:
V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O
I2+2Na2S2O3=Na2S4O6+2NaI
若三次滴定消耗标准溶液的平均体积为bmL,则该产品的纯度为
大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致
力“人工固氮”新方法的研究。
(1)有关大气固氮(以N2+O2![]() 2NO为例)、人工固氮(以为N2+3H2
2NO为例)、人工固氮(以为N2+3H2![]() 2NH3 为例)反应的平衡常数
2NH3 为例)反应的平衡常数![]() 的值如下表。
的值如下表。
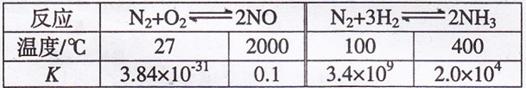
下列说法正确的是 填字母
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4KJ.mol-1
2NH3(g) △H=-92.4KJ.mol-1
2H2(g) + O2(g) = 2H2O(l) △H=-571.6KJ.mol-1
据报道,在常温、常压、光照、催化剂的条件下,![]() 可以与水反应,则反应
可以与水反应,则反应
N2(g) + 3H2O(l)= 2NH3(g) +3/2O2(g)的 △H= KJ.mol-1
(3)某研究小组在673 K、30 MPa下,在体积为VL的密闭容器中进行反应:,N2(g)+3H2(g)![]() 2NH3(g)其n(H2)和n(NH3)随时间变化的关系如图所示。
2NH3(g)其n(H2)和n(NH3)随时间变化的关系如图所示。
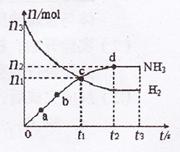
①下列叙述正确的是 填字母
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若如时由673 K升至773 K,则n(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示)v(H2)= .
③若开始时n(N2)= n(H2),则反应的平衡常数K= (用代数式表示).
查看习题详情和答案>> 若A~E均为单官能团有机物,它们之间有如下转化关系:
若A~E均为单官能团有机物,它们之间有如下转化关系:烯烃A的密度是相同条件下氧气密度的1.75倍;结构分析表明A没有顺反异构体;A的核磁共振氢谱共有两组峰,峰面积之比为1:3.B在一定条件下能与NaOH反应;D与NaHCO3反应放出无色无味的气体;E是一种有水果香气的无色液体,广泛存在于香蕉、葡萄、菠萝等水果以及啤酒花中,是一种重要的香料.
(1)D的结构简式为


(2)B在一定条件下变为A的化学方程式为


(3)A→C的反应类型
加成反应
加成反应
(4)A与X互为同分异构体,它们具有相同官能团.X经过下述变化可以生成J,J能脱水缩聚成高分子化合物K.

①化合物X的名称是
1-丁烯
1-丁烯
②写出结构简式:I


③由J生成K的化学方程式为
n
 +nH2O
+nH2O

| 一定条件 |
 +nH2O
+nH2On
 +nH2O
+nH2O

| 一定条件 |
 +nH2O
+nH2O④F有多种同分异构体,其中仅含有一个手性碳的结构是
CH2BrCH2CHBrCH3
CH2BrCH2CHBrCH3
.某化学兴趣小组测定某Fe2(SO4)3样品(只含少量Fec12杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取ag样品,置于烧杯中;
②加入50mL 1.0mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤 ②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…
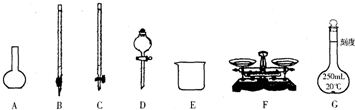
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和 (填字母).
(2)步骤②中:配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为 mL,量取该体积的浓H2SO4用到量筒规格是 .
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2++ ClO2+ ═ Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成 (填偏大、偏小或不影响),等物质的量的ClO2与Cl2的氧化效率之比为 .
(4)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 .
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会 (填偏大、偏小或不影响);若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为 ,(列出算式,不需化简)
查看习题详情和答案>>
①称取ag样品,置于烧杯中;
②加入50mL 1.0mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤 ②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…

请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和
(2)步骤②中:配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成
(4)第⑥步的操作中,将沉淀物转移到
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会
 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:(1)C元素的原子结构示意图


(2)A、B、D可组成化学式为D4B2A3的离子化合物,其水溶液呈酸性,原因是(用离子方程式表示)
NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(3)工业上合成B、D化合物的化学方程式:
N2+3H2 2NH3
2NH3
 2NH3
2NH3N2+3H2 2NH3
2NH3
选择合成温度的理由: 2NH3
2NH3加快反应速率,催化剂活性有效温度
加快反应速率,催化剂活性有效温度
当B、D形成的化合物液态时可发生微弱电离(电离过程与D2A的电离相似),电离产生的阴离子的电子式为

(4)已知:BA2+A2+D2A→DBA3.如图所示,若将一充满m ml BA2和A2混合气体的大试管倒立于D2A中,充分反应后,在相同条件下测
得试管中余下n ml气体,则:
①若余下n ml 气体为
O2
O2
,原混合物体中BA2的体积为| 4(m-n) |
| 5 |
| 4(m-n) |
| 5 |
| 4n+m |
| 5 |
| 4n+m |
| 5 |
②若余下n ml气体为
NO
NO
,原混合气体中BA2的体积为| 4m+3n |
| 5 |
| 4m+3n |
| 5 |
| m-3n |
| 5 |
| m-3n |
| 5 |