题目内容
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.
(1)钒主要用来制造钒钢.钒钢具有很高的耐磨损性和抗撞击性,原因是 (填序号)
A.钒在常温下,化学活泼性较弱
B.钒钢表面形成了致密且坚固的氧化膜
C.钒钢结构紧密,具有较高的韧性、弹性和强度
(2)在温度较低时,溶液中钒酸盐会转化为焦钒酸盐:
2VO43-+H2O?V2O74-+2OH-①
在温度较高时,焦钒酸盐又转化为偏钒酸盐:
V2O74-+H2O?2VO3-+2OH-②
反应②平衡常数的表达式K= ;
(3)已知某温度下:4V(s)+5O2(g)=2V2O5(s)△H=-1551kJ?mol-1
4V(s)+3O2(g)=2V2O3(s)△H=-1219kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
写出H2还原V2O5得到V2O3的热化学方程式: ;
(4)用钒酸钠(Na3VO4)溶液(含PO43-、SiO32-等杂质离子)制备高纯V2O5流程如下: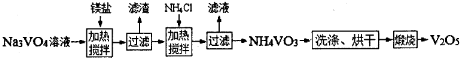
①加入镁盐,加热搅拌,其中加热的作用是 ;
②在25℃时,Ksp[Mg3(PO4)2]=1.0×10-26,若净化后溶液中的Mg2+的平衡浓度为 1.0×10-4 mol?L-1,则溶液中c(P043-)= ;
③加入NH4Cl,加热搅拌,该步骤反应的离子方程式为 ;
④为测定产品纯度,称取产品mg,溶解后定容在100mL容量瓶中,每次取5.00mL溶液于锥形瓶中,加入一定量的稀盐酸和KI溶液,用a mol?L-1Na2S2O3标准溶 液滴定,发生的反应为:
V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O
I2+2Na2S2O3=Na2S4O6+2NaI
若三次滴定消耗标准溶液的平均体积为bmL,则该产品的纯度为 (用含m、a、b的代数式表示).
(1)钒主要用来制造钒钢.钒钢具有很高的耐磨损性和抗撞击性,原因是
A.钒在常温下,化学活泼性较弱
B.钒钢表面形成了致密且坚固的氧化膜
C.钒钢结构紧密,具有较高的韧性、弹性和强度
(2)在温度较低时,溶液中钒酸盐会转化为焦钒酸盐:
2VO43-+H2O?V2O74-+2OH-①
在温度较高时,焦钒酸盐又转化为偏钒酸盐:
V2O74-+H2O?2VO3-+2OH-②
反应②平衡常数的表达式K=
(3)已知某温度下:4V(s)+5O2(g)=2V2O5(s)△H=-1551kJ?mol-1
4V(s)+3O2(g)=2V2O3(s)△H=-1219kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
写出H2还原V2O5得到V2O3的热化学方程式:
(4)用钒酸钠(Na3VO4)溶液(含PO43-、SiO32-等杂质离子)制备高纯V2O5流程如下:

①加入镁盐,加热搅拌,其中加热的作用是
②在25℃时,Ksp[Mg3(PO4)2]=1.0×10-26,若净化后溶液中的Mg2+的平衡浓度为 1.0×10-4 mol?L-1,则溶液中c(P043-)=
③加入NH4Cl,加热搅拌,该步骤反应的离子方程式为
④为测定产品纯度,称取产品mg,溶解后定容在100mL容量瓶中,每次取5.00mL溶液于锥形瓶中,加入一定量的稀盐酸和KI溶液,用a mol?L-1Na2S2O3标准溶 液滴定,发生的反应为:
V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O
I2+2Na2S2O3=Na2S4O6+2NaI
若三次滴定消耗标准溶液的平均体积为bmL,则该产品的纯度为
分析:(1)根据合金的性质分析;
(2)根据反应方程式和平衡常数的含义书写K的表达式;
(3)利用盖斯定律结合已知热化学方程式计算;
(4)①根据温度对反应速率的影响分析;
②已知Mg2+的平衡浓度,根据Ksp[Mg3(PO4)2]计算;
③根据流程可知NH4+与VO3-结合生成NH4VO3沉淀;
④根据反应方程式求出V2O5的物质的量,然后求出其质量,再求产品的纯度.
(2)根据反应方程式和平衡常数的含义书写K的表达式;
(3)利用盖斯定律结合已知热化学方程式计算;
(4)①根据温度对反应速率的影响分析;
②已知Mg2+的平衡浓度,根据Ksp[Mg3(PO4)2]计算;
③根据流程可知NH4+与VO3-结合生成NH4VO3沉淀;
④根据反应方程式求出V2O5的物质的量,然后求出其质量,再求产品的纯度.
解答:解:(1)根据合金的性质可知,合金的硬度一般比其成分金属的硬度大,钒与铁形成钒钢合金,钒钢合金结构紧密,具有较高的韧性、弹性和强度,
故答案为:C;
(2)已知反应方程式V2O74-+H2O?2VO3-+2OH-,则平衡常数的表达式为K=
,故答案为:
;
(3)已知某温度下:①4V(s)+5O2(g)=2V2O5(s)△H=-1551kJ?mol-1
②4V(s)+3O2(g)=2V2O3(s)△H=-1219kJ?mol-1
③2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
根据盖斯定律:
×②+③-
×①所得方程式为 V2O5(s)+2H2(g)=V2O3(s)+2H2O(l),则其△H=
(-1219)+(-571.6)-
(-1551)=-405.6kJ?mol-1;
所以H2还原V2O5得到V2O3的热化学方程式为:V2O5(s)+2H2(g)=V2O3(s)+2H2O(l)△H=-405.6kJ?mol-1;
故答案为:V2O5(s)+2H2(g)=V2O3(s)+2H2O(l)△H=-405.6kJ?mol-1;
(4)①升高温度能加快反应速率,所以加热的作用是提高生成沉淀的反应速率;故答案为:提高生成沉淀的反应速率;
②已知净化后溶液中的Mg2+的平衡浓度为 1.0×10-4 mol?L-1,所以c(P043-)=
=1.0×10-7mol?L-1;故答案为:1.0×10-7mol?L-1;
③根据流程可知NH4+与VO3-结合生成NH4VO3沉淀,所以其离子方程式为NH4++VO3-=NH4VO3↓,
故答案为:NH4++VO3-=NH4VO3↓;
④已知反应方程式为:V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O
I2+2Na2S2O3=Na2S4O6+2NaI,
设5.00mL溶液中V2O5的物质的量为xmol,
V2O5 ~I2 ~2Na2S2O3
1mol 2mol
xmol a×b×10-3mol
则x=
ab×10-3mol,所以100mL溶液中V2O5的物质的量为
×
ab×10-3mol=ab×10-2mol,则其质量为m=nM=ab×10-2mol×182g/mol=1.82abg,
所以该产品的纯度为
×100%=
%;
故答案为:
%.
故答案为:C;
(2)已知反应方程式V2O74-+H2O?2VO3-+2OH-,则平衡常数的表达式为K=
| [VO3-]2[OH-]2 |
| [V2O74-] |
| [VO3-]2[OH-]2 |
| [V2O74-] |
(3)已知某温度下:①4V(s)+5O2(g)=2V2O5(s)△H=-1551kJ?mol-1
②4V(s)+3O2(g)=2V2O3(s)△H=-1219kJ?mol-1
③2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
根据盖斯定律:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
所以H2还原V2O5得到V2O3的热化学方程式为:V2O5(s)+2H2(g)=V2O3(s)+2H2O(l)△H=-405.6kJ?mol-1;
故答案为:V2O5(s)+2H2(g)=V2O3(s)+2H2O(l)△H=-405.6kJ?mol-1;
(4)①升高温度能加快反应速率,所以加热的作用是提高生成沉淀的反应速率;故答案为:提高生成沉淀的反应速率;
②已知净化后溶液中的Mg2+的平衡浓度为 1.0×10-4 mol?L-1,所以c(P043-)=
|
③根据流程可知NH4+与VO3-结合生成NH4VO3沉淀,所以其离子方程式为NH4++VO3-=NH4VO3↓,
故答案为:NH4++VO3-=NH4VO3↓;
④已知反应方程式为:V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O
I2+2Na2S2O3=Na2S4O6+2NaI,
设5.00mL溶液中V2O5的物质的量为xmol,
V2O5 ~I2 ~2Na2S2O3
1mol 2mol
xmol a×b×10-3mol
则x=
| 1 |
| 2 |
| 100 |
| 5 |
| 1 |
| 2 |
所以该产品的纯度为
| 1.82ab |
| m |
| 182ab |
| m |
故答案为:
| 182ab |
| m |
点评:本题考查了合金的性质、平衡常数、盖斯定律的应用、Ksp的有关计算、有关方程式的计算等,涉及的知识点较多,题目难度较大,侧重于学生综合能力的考查.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
随着材料科学的发展,金属钒被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺.
己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如下:
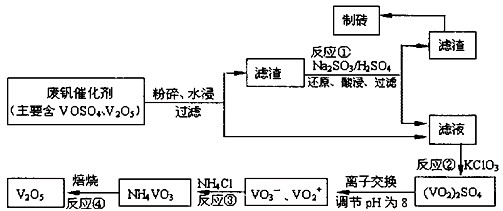
请回答下列问题
(1)工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 .
(2)反应①的离子方程式是 .
(3)在反应②中,每生成1mol(VO2)2SO4转移电子的数目为 .
(4)在离子交换过程中,发生可逆反应VO2++2OH-?VO3-+H2O.
该反应的化学平衡常数K 的表达式为 .
(5)反应③充分反应后,分离出NH4VO3的实验所需主要玻璃仪器为 ,为保证产品纯度,还应进行的操作名称是 .
己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题
(1)工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式
(2)反应①的离子方程式是
(3)在反应②中,每生成1mol(VO2)2SO4转移电子的数目为
(4)在离子交换过程中,发生可逆反应VO2++2OH-?VO3-+H2O.
该反应的化学平衡常数K 的表达式为
(5)反应③充分反应后,分离出NH4VO3的实验所需主要玻璃仪器为

 其中a、c二步的化学方程式可表示为
其中a、c二步的化学方程式可表示为
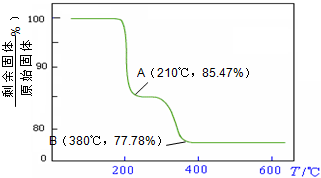 则NH4VO3在分解过程中
则NH4VO3在分解过程中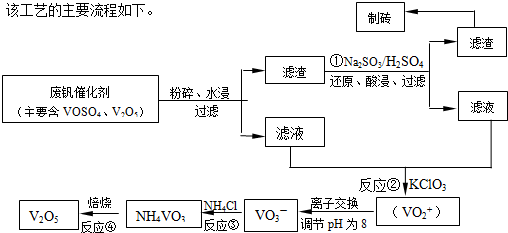
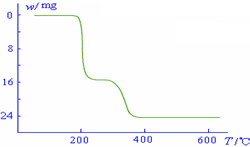 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中