网址:http://m.1010jiajiao.com/timu3_id_54076[举报]
①Li4Ti5O12中Ti元素的化合价为
②该锂电池是一种二次电池,放电时的负极反应式为
(2)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
①TiCl4水解生成TiO2?xH2O的化学方程式为
②滴定终点的现象是
③滴定分析时,称取TiO2试样0.2g,消耗0.1mol?L-1 NH4Fe(SO4)2栎准溶液20ml.则TiO2的质量分数为
④若在滴定终点,读取滴定管刻度时,俯视标准溶液的液面,使其测定结果
(3)已知:
Ti(s)+2Cl2(g)=TiCl4(l)△H=-804.2kJ?mol-1
2Na(s)+Cl2(g)=2NaCl(s)△H=-882.0kJ?mol-1
Na(s)=Na(l)△H=+2.6kJ?mol-1
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的△H=
制备纳米TiO2的方法之一是TiCl4水解生成TiO2?x H2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
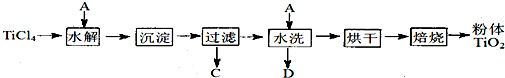
用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.请回答下列问题:
(1)TiCl4水解生成TiO2?x H2O的化学方程式为
(2)检验TiO2?x H2O中Cl-是否被除净的方法是
(3)下列可用于测定TiO2粒子大小的方法是
a.滴定法 b.重量法 c.排液量气法 d.透射电子显微镜法
(4)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是

(5)滴定Ti3+时的离子方程式为
滴定终点的现象是
(6)称取TiO2(式量为M)试样w g,配成100mL溶液,取出25mL,进行滴定分析,消耗c mol?L-1 NH4Fe(SO4)2标准溶液V mL.TiO2质量分数表达式为
(7)下列操作会导致TiO2质量分数测定结果偏高的是
a、滴定终点读取滴定管刻度时,俯视标准液液面.b、配制标准溶液时,烧杯中的NH4Fe(SO4)2溶液有少量溅出.
c、容量瓶清洗之后,未干燥. d、配制标准溶液定容时,俯视刻度线.
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案,检验其中的Na2CO3和Na2O.在答题卡上写出实验步骤、预期现象和结论.(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡
| 实验操作 | 预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用. | 有不溶的黑色固体. |
| 步骤2:取适量步骤1清液于试管中, |
|
| 步骤3: |
步骤1:准确称取w克试样,溶解、过滤后准确配制成250mL溶液.
步骤2:准确量取25.00mL所配溶液于锥形瓶中,滴加几滴指示剂A,滴加c mol/L的标准盐酸至溶液的pH约为8.2(碳的主要存在形式为HCO3-),消耗盐酸的体积为V1mL;再滴加几滴甲基橙,继续用上述盐酸滴至溶液由黄色变橙色,消耗盐酸的体积为V2mL.
步骤3:重复实验3次.滴定结果如下
| 滴定 次数 |
待测溶液 的体积/mL |
消耗标准盐酸的体积 | |
| V1/mL | V2/mL | ||
| 1 | 25.00 | 15.02 | 4.97 |
| 2 | 25.00 | 14.98 | 5.03 |
| 3 | 25.00 | 13.21 | 6.75 |
②计算Na2CO3的质量分数=
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。

(3)乙学生做了三组平行实验,数据记录如下:
|
实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1HCl溶液的体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
1 |
25.00 |
0.00 |
26.29 |
|
2 |
25.00 |
1.56 |
31.30 |
|
3 |
25.00 |
1.00 |
27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看习题详情和答案>>
1)一种新型锂电池是将化学式为Li4Ti5O12的物质作为电池的正极材料,在放电的过程中变为化学式为Li4Ti5O12的物质。
①Li4Ti5O12中Ti元素的化合价为 ,锂电池的突出优点是 。
②该锂电池是一种二次电池,放电时的负极反应式为 ,充电时的阳极反应式为 。
(2)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为 。
②滴定终点的现象是 。
③滴定分析时,称取TiO2试样0.2g,消耗0.1mol·L-1 NH4Fe(SO4)2栎准溶液20ml.则TiO2的质量分数为____ 。
④若在滴定终点,读取滴定管刻度时,俯视标准溶液的液面,使其测定结果 (填“偏大”、“偏小”或“无影响”)o
(3)已知:

则TiCl4(I)+4Na(l)=Ti(s)+4NaCl(s)的△H= KJ·mol-1。
查看习题详情和答案>>