题目内容
1)一种新型锂电池是将化学式为Li4Ti5O12的物质作为电池的正极材料,在放电的过程中变为化学式为Li4Ti5O12的物质。
①Li4Ti5O12中Ti元素的化合价为 ,锂电池的突出优点是 。
②该锂电池是一种二次电池,放电时的负极反应式为 ,充电时的阳极反应式为 。
(2)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为 。
②滴定终点的现象是 。
③滴定分析时,称取TiO2试样0.2g,消耗0.1mol·L-1 NH4Fe(SO4)2栎准溶液20ml.则TiO2的质量分数为____ 。
④若在滴定终点,读取滴定管刻度时,俯视标准溶液的液面,使其测定结果 (填“偏大”、“偏小”或“无影响”)o
(3)已知:
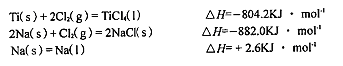
则TiCl4(I)+4Na(l)=Ti(s)+4NaCl(s)的△H= KJ·mol-1。
(1)①+4(1分)体积小、比能量高、携带方便。(1分)
②Li-e-=Li+(1分)Li7Ti5O12-3e-=Li4Ti5O12+3Li+(2分)
(2)①TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl(2分)②溶液变成红色(1分)
③80%(2分)④偏小(1分)
(3)-970.2(2分)
【解析】
(1)①根据化合物化合价代数和等于零,锂为+1价,氧为-2价,则钛为+4价;②放电发生原电池反应,负极Li-e-=Li+;充电发生电解池反应,阳极与外接电源的正极相连失去电子,发生氧化反应,Li7Ti5O12-3e-=Li4Ti5O12+3Li+;
(2)①TiCl4水解生成TiO2•xH2O,根据TiO2的化学式,应有2mol水参与反应,故方程式为TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl。③n(NH4Fe(SO4)2)=0.1mol/Lⅹ0.02L=0.002mol,此反应是氧化还原反应,根据电子得失守恒,n(NH4Fe(SO4)2)=n(TiO2),m(TiO2)=0.002molⅹ80g·mol-1,0.002ⅹ80/0.2=0.80。④滴定终点,俯视读数,读出的数值偏大,则体积差值偏小,故测定结果偏低。(3)根据盖斯定律,把题中的方程式组合就可得到结果。
TiCl4(l)=Ti(s)+2Cl2(g),ΔH=804.2KJ·mol-
4Na(s)+2Cl2(g)=4NaCl(s) ΔH=-2ⅹ882.0KJ·mol-
4Na(l)=4Na(s) ΔH=-4ⅹ2.6KJ·mol-
以上三个相加,就得到△H=-970.2KJ·mol-

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料。某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
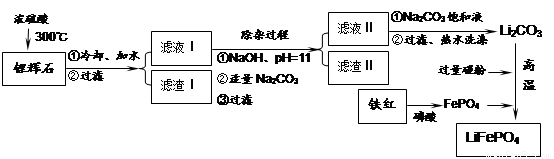
已知:2LiAl(SiO3)2
+ H2SO4(浓) 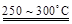 Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
|
温度/℃ |
20 |
40 |
60 |
80 |
|
溶解度(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
溶解度(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣Ⅰ中可分离出Al2O3,如下图所示。请写出生成沉淀的离子方程式 。
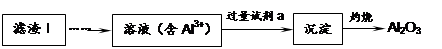
(2)滤渣Ⅱ的主要成分是: (填化学式)。
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)写出在高温下生成磷酸亚铁锂的化学方程式 。
(5)磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:
。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为
。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:
。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为
。
 “氢”既是重要的化工原料,也是未来最理想的新能源.
“氢”既是重要的化工原料,也是未来最理想的新能源.