摘要:15.某学习小组研究Cr2O3催化氧化SO2生成SO3的部分实验装置如下图所示. (1)C处发生反应的化学方程式是 ▲ . (2)实验中能证明有SO3生成的现象是 ▲ . (3)欲使进入C反应器内O2和SO2的体积比为2 :1.监控方法是 ▲ .(4)实验中观察到E瓶内有气泡.而D瓶中无明显现象.原因是▲.(5)如果用止水夹夹紧k处的乳胶管.D瓶中可见持续稳定的气泡出现.证明浓硫酸能吸收的SO3方法是▲ .
网址:http://m.1010jiajiao.com/timu3_id_54015[举报]
某学习小组研究某酸性工业废水样品,以下实验操作或分析结论中,正确的是( )
| A、用玻璃棒蘸取废水样品,沾在用蒸馏水润湿的pH试纸上测定其pH | B、将无色酚酞试液滴入废水样品中以验证其酸性 | C、该工业废水中c(H+)>c(OH-) | D、测得废水样品的pH=4,说明该废水样品中c(H+)=4.0 mol?L-1 |
某学习小组研究同周期元素性质递变规律时,设计并进行了下列实验(表中的“实验步骤”与“实验现象”前后不一定是对应关系).
(1)请将各实验步骤对应的实验现象填写入下表中:
(2)此实验可得出的结论是:
金属性比较:
(3)请写出反应②的离子方程式
查看习题详情和答案>>
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
| 实验步骤 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | ▲ | ▲ | ▲ | C | D | ▲ |
金属性比较:
Na>Mg>Al
Na>Mg>Al
,非金属性比较:Cl>S
Cl>S
;(3)请写出反应②的离子方程式
S2-+Cl2=S↓+2Cl-
S2-+Cl2=S↓+2Cl-
.
控制变量法是化学实验的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):
分析以下数据,回答下列问题:
(1)实验1和实验2表明, 对反应速率有影响,对同一规律进行研究的实验还有一组是 (填实验序号).
(2)下列说法正确的是
A.t1<70 B.m1<m2 C.m6=19.3 D.t1>t4
(3)本实验还可以研究 对化学反应速率的影响.
(4)硫酸的物质的量浓度是 mol/L,实验6生成的硫酸锌的质量m5= g.
查看习题详情和答案>>
分析以下数据,回答下列问题:
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| 2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| 4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| 5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| 6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| 7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| 8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| 9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| 10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
(2)下列说法正确的是
A.t1<70 B.m1<m2 C.m6=19.3 D.t1>t4
(3)本实验还可以研究
(4)硫酸的物质的量浓度是
控制变量法是化学实验中的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):
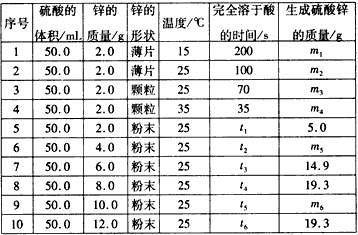
分析上表数据,回答下列问题:
(1)实验1和实验2表明__________ 对反应速率有影响,对这一规律进行研究的实验还有一组是________(填实验序号)。
(2)下列数据推断正确的是_________。
A.t1<70
B.ml< m2
C.m6=19. 3
D.t1>t4
(3)本实验还可以研究____________对化学反应速率的影响。
(4)硫酸的物质的量浓度是____mol/L,实验6生成的硫酸锌的质量m5=_________。
查看习题详情和答案>>
(1)实验1和实验2表明__________ 对反应速率有影响,对这一规律进行研究的实验还有一组是________(填实验序号)。
(2)下列数据推断正确的是_________。
A.t1<70
B.ml< m2
C.m6=19. 3
D.t1>t4
(3)本实验还可以研究____________对化学反应速率的影响。
(4)硫酸的物质的量浓度是____mol/L,实验6生成的硫酸锌的质量m5=_________。
(12分)控制变量法是化学实验的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/ ℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
分析以下数据,回答下列问题:
(1)实验1和实验2表明,______________对反应速率有影响,对同一规律进行研究的实验还有一组是______________________(填实验序号)。
(2)下列说法正确的是_______
A.t1<70 B. m1<m2 C. m6=19.3 D. t1>t4
(3)本实验还可以研究___________________________对化学反应速率的影响。
(4)硫酸的物质的量浓度是______mol/L, 实验6生成的硫酸锌的质量m5=________g。
查看习题详情和答案>>