题目内容
控制变量法是化学实验的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):分析以下数据,回答下列问题:
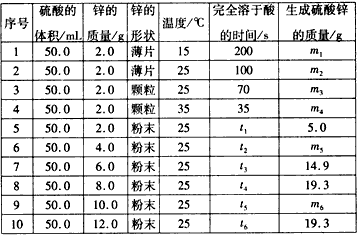
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| 2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| 4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| 5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| 6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| 7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| 8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| 9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| 10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
(2)下列说法正确的是
A.t1<70 B.m1<m2 C.m6=19.3 D.t1>t4
(3)本实验还可以研究
(4)硫酸的物质的量浓度是
分析:(1)根据实验1和实验2中的温度相同、其它的反应条件进行分析;根据表中数据找出只有温度不同其它条件都相同的实验;
(2)根据表中的数据及影响反应速率的因素判断各反应时间、生成硫酸锌的质量大小;
(3)根据影响反应速率的因素除了温度、固体表面积外,含有硫酸的浓度、催化剂等判断;
(4)实验8以后,硫酸完全反应,根据硫酸锌的质量计算出硫酸的物质的量浓度;根据实验5中锌完全反应计算出硫酸锌的质量.
(2)根据表中的数据及影响反应速率的因素判断各反应时间、生成硫酸锌的质量大小;
(3)根据影响反应速率的因素除了温度、固体表面积外,含有硫酸的浓度、催化剂等判断;
(4)实验8以后,硫酸完全反应,根据硫酸锌的质量计算出硫酸的物质的量浓度;根据实验5中锌完全反应计算出硫酸锌的质量.
解答:解:(1)根据表中数据可知,实验1和实验2除了温度不同以外,其它条件完全相同,说明研究的是温度对反应速率的影响;实验3和实验4除了温度不同,其它的反应条件完全相同,说明研究的也是温度对反应速率的影响,
故答案为:温度;3和4;
(2)A.由于实验3和实验5中,只有锌的规格不同,而实验5的锌为粉末,接触面积大,反应速率比实验3大,所以t1<70,故B正确;
B.由于实验1和实验2中反应物的量完全相同,所以生成的硫酸锌的质量一定相等,即m1=m2,故B错误;
C.从表中数据可知,从实验8开始,硫酸完全反应,所以m6=19.3,故C正确;
D.实验5和实验8,只有锌的质量不同,其它条件完全相同,实验5中生成的硫酸锌质量少,需要的时间短,即t1<t4,故D错误;
故答案为:AC;
(3)影响反应速率的因素有浓度、温度、催化剂、压强等,所以还可以研究硫酸的浓度和催化剂(或压强)对反应速率的影响,
故答案为:硫酸的浓度和催化剂(或压强);
(4)根据表中数据可知,从实验8开始,硫酸完全反应,生成的硫酸锌的质量为19.3g,硫酸锌的物质的量为:
=0.12mol,
硫酸的浓度为:
=2.4mol/L,
实验6中硫酸过量,锌完全反应,生成硫酸锌的物质的量为:
,硫酸锌的质量为:161g/mol×
≈9.9g,
故答案为:2.4; 9.9.
故答案为:温度;3和4;
(2)A.由于实验3和实验5中,只有锌的规格不同,而实验5的锌为粉末,接触面积大,反应速率比实验3大,所以t1<70,故B正确;
B.由于实验1和实验2中反应物的量完全相同,所以生成的硫酸锌的质量一定相等,即m1=m2,故B错误;
C.从表中数据可知,从实验8开始,硫酸完全反应,所以m6=19.3,故C正确;
D.实验5和实验8,只有锌的质量不同,其它条件完全相同,实验5中生成的硫酸锌质量少,需要的时间短,即t1<t4,故D错误;
故答案为:AC;
(3)影响反应速率的因素有浓度、温度、催化剂、压强等,所以还可以研究硫酸的浓度和催化剂(或压强)对反应速率的影响,
故答案为:硫酸的浓度和催化剂(或压强);
(4)根据表中数据可知,从实验8开始,硫酸完全反应,生成的硫酸锌的质量为19.3g,硫酸锌的物质的量为:
| 19.3g |
| 161g/mol |
硫酸的浓度为:
| 0.12mol |
| 0.05L |
实验6中硫酸过量,锌完全反应,生成硫酸锌的物质的量为:
| 4.g |
| 65g/mol |
| 4.g |
| 65g/mol |
故答案为:2.4; 9.9.
点评:本题考查温度、固体接触面积对反应速率的影响,题目难度中等,题中数据较多,需要细致分析,充分考查了学生的分析、理解信息能力和灵活应用所学知识的能力.

练习册系列答案
相关题目
(12分)控制变量法是化学实验的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/ ℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
分析以下数据,回答下列问题:
(1)实验1和实验2表明,______________对反应速率有影响,对同一规律进行研究的实验还有一组是______________________(填实验序号)。
(2)下列说法正确的是_______
A.t1<70 B. m1<m2 C. m6=19.3 D. t1>t4
(3)本实验还可以研究___________________________对化学反应速率的影响。
(4)硫酸的物质的量浓度是______mol/L, 实验6生成的硫酸锌的质量m5=________g。
 05mol/L、0. 01mol/L、0. OO1mol/L的KMnO4酸性溶液和浓度均为0. OO1mol/L的H2C2O4溶液反应,来操纵实验变量,进行对照实验
05mol/L、0. 01mol/L、0. OO1mol/L的KMnO4酸性溶液和浓度均为0. OO1mol/L的H2C2O4溶液反应,来操纵实验变量,进行对照实验