网址:http://m.1010jiajiao.com/timu3_id_53067[举报]
(1)实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中

(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:
(3)装置C的作用是
(4)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性.试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是:
(1)写出并配平该氧化还原反应的离子方程式:
(2)向(1)中反应后的溶液里加入酸性高锰酸钾溶液,得还原产物Mn2+(无色),反应的离子方程式为
(3)某同学用上述原理测定一种含Cu2O的矿石中Cu2O的质量分数:称量5.0g矿石溶于足量的硫酸铁和硫酸的混合溶液中,充分反应后,用酸性高锰酸钾溶液滴定,消耗0.100 0mol?L-1的高锰酸钾溶液的体积为100.00mL.
①滴定时,滴定终点的颜色为
②该同学测得矿石样品中Cu2O的质量分数为
③下列情况使测定结果一定偏高的是
A.开始和终点都是仰视读数
B.没有用待装液润洗滴定管
C.称量时,砝码与样品放反了
D.样品中含有较强还原性杂质
E.高锰酸钾溶液中含有N
| O | - 3 |
F.用酸性高锰酸钾溶液润洗锥形瓶.
(18分)Ⅰ测定水中溶解氧的方法是:在水中加入硫酸锰及氢氧化钠和碘化钾溶液,生成氢氧化锰沉淀。氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰:
2MnSO4+4NaOH=2Mn(OH)2↓+2Na2SO4--------------①
2Mn(OH)2+O2=2H2MnO3---------------------------②
H2MnO3十Mn(OH)2=MnMnO3↓+2H2O------③
加入硫酸溶液,使沉淀(MnMnO3)与溶液中所加入的碘化钾发生反应,
2KI+H2SO4=2HI+K2SO4--------------------------- --------④
MnMnO3+2H2SO4+2HI=2MnSO4+I2+3H2O ----—⑤
用已知浓度的Na2S2O3溶液滴定生成的碘,根据消耗的Na2S2O3的体积可以测定水中溶氧量(mg/L)
I2+2Na2S2O3=2NaI+Na2S4O6
测定中,用移液管取50.00 mL水样,迅速加入预先配置好的MnSO4和NaOH混合溶液,再加入KI溶液,立即塞好塞子,震荡使反应完全。打开塞子,迅速加入适量的稀硫酸,期间发生①—⑤反应生成单质碘。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了2.68mL Na2S2O3溶液。
已知:H2S2O3 为弱酸
回答下列问题:
(1)盛放Na2S2O3溶液的滴定管种类为
(2)该滴定的指示剂为 ,滴定时,溶液由 色到 色,且半分钟内颜色不再变化即达到滴定终点
(3)下列操作和该滴定有关并会导致测定水中溶氧偏高的是( )
A滴定前滴定管尖嘴无气泡,滴定结束尖嘴有气泡 B锥形瓶用待装液润洗
C滴定管读数开始平视,滴定结束时立即平视读数 D酸式滴定管没有用待装液润洗
(4)水中溶氧量为 mg/L水。
Ⅱ50.00mL0.50mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液在下图装置中进行中和反应,通过测定反应前盐酸和氢氧化钠溶液各自的温度和中和过程中混合液的最高温度可计算中和热.试回答下列问题.
(1)该实验装置设计中缺少的仪器的名称为
(2)若实验测得放出热量为1.43kJ,写出表示中和热的热化学方程式
(3)改用60.0mL0.5mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量 等,所求中和热数值 等。(填“相等,不相等”)
2MnSO4+4NaOH=2Mn(OH)2↓+2Na2SO4--------------①
2Mn(OH)2+O2=2H2MnO3---------------------------②
H2MnO3十Mn(OH)2=MnMnO3↓+2H2O------③
加入硫酸溶液,使沉淀(MnMnO3)与溶液中所加入的碘化钾发生反应,
2KI+H2SO4=2HI+K2SO4--------------------------- --------④
MnMnO3+2H2SO4+2HI=2MnSO4+I2+3H2O ----—⑤
用已知浓度的Na2S2O3溶液滴定生成的碘,根据消耗的Na2S2O3的体积可以测定水中溶氧量(mg/L)
I2+2Na2S2O3=2NaI+Na2S4O6
测定中,用移液管取50.00 mL水样,迅速加入预先配置好的MnSO4和NaOH混合溶液,再加入KI溶液,立即塞好塞子,震荡使反应完全。打开塞子,迅速加入适量的稀硫酸,期间发生①—⑤反应生成单质碘。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了2.68mL Na2S2O3溶液。
已知:H2S2O3 为弱酸
回答下列问题:
(1)盛放Na2S2O3溶液的滴定管种类为
(2)该滴定的指示剂为 ,滴定时,溶液由 色到 色,且半分钟内颜色不再变化即达到滴定终点
(3)下列操作和该滴定有关并会导致测定水中溶氧偏高的是( )
A滴定前滴定管尖嘴无气泡,滴定结束尖嘴有气泡 B锥形瓶用待装液润洗
C滴定管读数开始平视,滴定结束时立即平视读数 D酸式滴定管没有用待装液润洗
(4)水中溶氧量为 mg/L水。
Ⅱ50.00mL0.50mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液在下图装置中进行中和反应,通过测定反应前盐酸和氢氧化钠溶液各自的温度和中和过程中混合液的最高温度可计算中和热.试回答下列问题.

(1)该实验装置设计中缺少的仪器的名称为
(2)若实验测得放出热量为1.43kJ,写出表示中和热的热化学方程式
(3)改用60.0mL0.5mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量 等,所求中和热数值 等。(填“相等,不相等”)
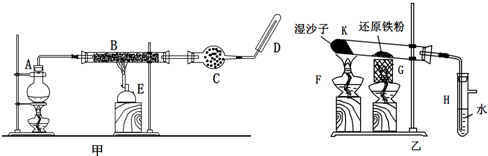
已知:B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯.对比两装置,回答下列问题:
(1)如何检查乙装置的气密性:
(2)乙装置中湿沙子的作用是:
(3)B处发生反应的化学方程式:
(4)对比甲、乙两装置的B和K,B的优点是:
(5)称取mg铁粉与适量石棉绒混合,然后加热至无气体放出.若收集的气体体积换算为标准状况为VL,铁粉的转化率为(列出计算式即可)
(6)为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入一定量的盐酸使固体混合物溶解,过滤,立即向滤液中滴加KSCN溶液,结果观察到溶液的颜色没变化.经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe.他的理由是: