题目内容
在氧化还原反应中,氧化过程和还原过程是同时发生的两个半反应.Cu2O-2e-+2H+═2Cu2++H2O是一个半反应式.下列五种物质FeSO4、Fe2(SO4)3、CuSO4、Na2CO3、KI中的一种能使上述半反应顺利发生.
(1)写出并配平该氧化还原反应的离子方程式:
(2)向(1)中反应后的溶液里加入酸性高锰酸钾溶液,得还原产物Mn2+(无色),反应的离子方程式为
(3)某同学用上述原理测定一种含Cu2O的矿石中Cu2O的质量分数:称量5.0g矿石溶于足量的硫酸铁和硫酸的混合溶液中,充分反应后,用酸性高锰酸钾溶液滴定,消耗0.100 0mol?L-1的高锰酸钾溶液的体积为100.00mL.
①滴定时,滴定终点的颜色为
②该同学测得矿石样品中Cu2O的质量分数为
③下列情况使测定结果一定偏高的是
A.开始和终点都是仰视读数
B.没有用待装液润洗滴定管
C.称量时,砝码与样品放反了
D.样品中含有较强还原性杂质
E.高锰酸钾溶液中含有N
F.用酸性高锰酸钾溶液润洗锥形瓶.
(1)写出并配平该氧化还原反应的离子方程式:
Cu2O+2H++2Fe3+=2Cu2++H2O+2Fe2+
Cu2O+2H++2Fe3+=2Cu2++H2O+2Fe2+
.(2)向(1)中反应后的溶液里加入酸性高锰酸钾溶液,得还原产物Mn2+(无色),反应的离子方程式为
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
;判断Cu2+、MnO-、Fe3+的氧化性由强到弱的顺序是MnO4-、Fe3+、Cu2+
MnO4-、Fe3+、Cu2+
(用离子符号表示).(3)某同学用上述原理测定一种含Cu2O的矿石中Cu2O的质量分数:称量5.0g矿石溶于足量的硫酸铁和硫酸的混合溶液中,充分反应后,用酸性高锰酸钾溶液滴定,消耗0.100 0mol?L-1的高锰酸钾溶液的体积为100.00mL.
①滴定时,滴定终点的颜色为
无色变为紫红色,30秒内不褪色
无色变为紫红色,30秒内不褪色
.②该同学测得矿石样品中Cu2O的质量分数为
72%
72%
.③下列情况使测定结果一定偏高的是
BD
BD
.A.开始和终点都是仰视读数
B.没有用待装液润洗滴定管
C.称量时,砝码与样品放反了
D.样品中含有较强还原性杂质
E.高锰酸钾溶液中含有N
| O | - 3 |
F.用酸性高锰酸钾溶液润洗锥形瓶.
分析:(1)根据题意知,已知的是氧化反应,则另一个是还原反应,氧化剂在反应中得电子发生还原反应.
(2)二价铁离子有还原性,酸性条件下高锰酸根离子有强氧化性,所以亚铁离子和高锰酸根离子能发生氧化还原反应生成铁离子、二价锰离子和水;同一化学反应中氧化剂的氧化性大于氧化产物的氧化性,从而得出几种离子氧化性的强弱.
(3)①滴定终点为:无色变为紫红色,30秒内不褪色.
②先根据高锰酸钾溶液的物质的量计算亚铁离子的物质的量,再根据亚铁离子的物质的量计算氧化亚铜的质量,从而计算其质量分数.
③根据滴定过程中使用高锰酸钾溶液的体积偏大还是偏小判断溶液的浓度.
(2)二价铁离子有还原性,酸性条件下高锰酸根离子有强氧化性,所以亚铁离子和高锰酸根离子能发生氧化还原反应生成铁离子、二价锰离子和水;同一化学反应中氧化剂的氧化性大于氧化产物的氧化性,从而得出几种离子氧化性的强弱.
(3)①滴定终点为:无色变为紫红色,30秒内不褪色.
②先根据高锰酸钾溶液的物质的量计算亚铁离子的物质的量,再根据亚铁离子的物质的量计算氧化亚铜的质量,从而计算其质量分数.
③根据滴定过程中使用高锰酸钾溶液的体积偏大还是偏小判断溶液的浓度.
解答:解:(1)反应Cu2O-2e-+2H+═2Cu2++H2O中失电子,所以另一个半反应中得电子,发生还原反应,根据提供的物质知,硫酸铁作氧化剂得电子生成硫酸亚铁,所以该反应的离子方程式为:Cu2O+2H++2Fe3+=2Cu2++H2O+2Fe2+
故答案为:Cu2O+2H++2Fe3+=2Cu2++H2O+2Fe2+.
(2)亚铁离子有还原性,酸性条件下高锰酸根离子有强氧化性,所以二价亚铁离子和高锰酸根离子发生氧化还原反应生成铁离子和二价锰离子,离子方程式为:5Fe2++MnO4-+8H+=5 Fe3++Mn2++4H2O,该反应中高锰酸根离子的氧化性大于铁离子的氧化性,反应Cu2O+2H++Fe3+=2Cu2++H2O+Fe2+中铁离子氧化性大于铜离子,所以Cu2+、MnO4-、Fe3+的氧化性由强到弱的顺序MnO4-、Fe3+、Cu2+.
故答案为:5Fe2++MnO4-+8H+=5 Fe3++Mn2++4H2O;MnO4-、Fe3+、Cu2+.
(3)①滴定终点为:无色变为紫红色,30秒内不褪色.
故答案为:无色变为紫红色,30秒内不褪色.
②设亚铁离子的物质的量为x.
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5mol 1mol
x 0.100 0mol?L-1×0.1L.
x=0.05mol
设氧化亚铜的质量是y.
Cu2O+2H++2Fe3+=2Cu2++H2O+2Fe2+
144g 2mol
y 0.05mol
y=3.6g
所以氧化亚铜的质量分数=
×100%=72%.
故答案为72%.
③A.开始和终点都是仰视读数,溶液的体积不变,所测浓度不变,故A错误.
B.没有用待装液润洗滴定管,导致使用溶液的体积偏大,所测浓度偏高,故B正确.
C.称量时,砝码与样品放反了,游码未动,药品质量和砝码质量相等,所测浓度不变,故C错误.
D.样品中含有较强还原性杂质,导致使用溶液的体积偏大,所测浓度偏高,故D正确.
E.高锰酸钾溶液中含有N
,导致使用溶液的体积偏小,所测浓度偏低,故E错误.
F.用酸性高锰酸钾溶液润洗锥形瓶,导致所以溶液体积偏小,所测溶液浓度偏低,故F错误.
故选BD.
故答案为:Cu2O+2H++2Fe3+=2Cu2++H2O+2Fe2+.
(2)亚铁离子有还原性,酸性条件下高锰酸根离子有强氧化性,所以二价亚铁离子和高锰酸根离子发生氧化还原反应生成铁离子和二价锰离子,离子方程式为:5Fe2++MnO4-+8H+=5 Fe3++Mn2++4H2O,该反应中高锰酸根离子的氧化性大于铁离子的氧化性,反应Cu2O+2H++Fe3+=2Cu2++H2O+Fe2+中铁离子氧化性大于铜离子,所以Cu2+、MnO4-、Fe3+的氧化性由强到弱的顺序MnO4-、Fe3+、Cu2+.
故答案为:5Fe2++MnO4-+8H+=5 Fe3++Mn2++4H2O;MnO4-、Fe3+、Cu2+.
(3)①滴定终点为:无色变为紫红色,30秒内不褪色.
故答案为:无色变为紫红色,30秒内不褪色.
②设亚铁离子的物质的量为x.
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5mol 1mol
x 0.100 0mol?L-1×0.1L.
x=0.05mol
设氧化亚铜的质量是y.
Cu2O+2H++2Fe3+=2Cu2++H2O+2Fe2+
144g 2mol
y 0.05mol
y=3.6g
所以氧化亚铜的质量分数=
| 3.6g |
| 5.0g |
故答案为72%.
③A.开始和终点都是仰视读数,溶液的体积不变,所测浓度不变,故A错误.
B.没有用待装液润洗滴定管,导致使用溶液的体积偏大,所测浓度偏高,故B正确.
C.称量时,砝码与样品放反了,游码未动,药品质量和砝码质量相等,所测浓度不变,故C错误.
D.样品中含有较强还原性杂质,导致使用溶液的体积偏大,所测浓度偏高,故D正确.
E.高锰酸钾溶液中含有N
| O | - 3 |
F.用酸性高锰酸钾溶液润洗锥形瓶,导致所以溶液体积偏小,所测溶液浓度偏低,故F错误.
故选BD.
点评:本题考查了氧化还原反应和酸碱中和滴定等知识点,难度较大,明确同一化学反应中氧化剂的氧化性大于氧化产物的氧化性.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
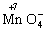 氧化为
氧化为