题目内容
(18分)Ⅰ测定水中溶解氧的方法是:在水中加入硫酸锰及氢氧化钠和碘化钾溶液,生成氢氧化锰沉淀。氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰:
2MnSO4+4NaOH=2Mn(OH)2↓+2Na2SO4--------------①
2Mn(OH)2+O2=2H2MnO3---------------------------②
H2MnO3十Mn(OH)2=MnMnO3↓+2H2O------③
加入硫酸溶液,使沉淀(MnMnO3)与溶液中所加入的碘化钾发生反应,
2KI+H2SO4=2HI+K2SO4--------------------------- --------④
MnMnO3+2H2SO4+2HI=2MnSO4+I2+3H2O ----—⑤
用已知浓度的Na2S2O3溶液滴定生成的碘,根据消耗的Na2S2O3的体积可以测定水中溶氧量(mg/L)
I2+2Na2S2O3=2NaI+Na2S4O6
测定中,用移液管取50.00 mL水样,迅速加入预先配置好的MnSO4和NaOH混合溶液,再加入KI溶液,立即塞好塞子,震荡使反应完全。打开塞子,迅速加入适量的稀硫酸,期间发生①—⑤反应生成单质碘。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了2.68mL Na2S2O3溶液。
已知:H2S2O3 为弱酸
回答下列问题:
(1)盛放Na2S2O3溶液的滴定管种类为
(2)该滴定的指示剂为 ,滴定时,溶液由 色到 色,且半分钟内颜色不再变化即达到滴定终点
(3)下列操作和该滴定有关并会导致测定水中溶氧偏高的是( )
A滴定前滴定管尖嘴无气泡,滴定结束尖嘴有气泡 B锥形瓶用待装液润洗
C滴定管读数开始平视,滴定结束时立即平视读数 D酸式滴定管没有用待装液润洗
(4)水中溶氧量为 mg/L水。
Ⅱ50.00mL0.50mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液在下图装置中进行中和反应,通过测定反应前盐酸和氢氧化钠溶液各自的温度和中和过程中混合液的最高温度可计算中和热.试回答下列问题.
(1)该实验装置设计中缺少的仪器的名称为
(2)若实验测得放出热量为1.43kJ,写出表示中和热的热化学方程式
(3)改用60.0mL0.5mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量 等,所求中和热数值 等。(填“相等,不相等”)
(18分)
(1)滴定管种类为件事滴定管
(2)指示剂为 淀粉 ,溶液由 蓝 色到 淡黄(棕色) 色,
(3)下列操作和该滴定有关并会导致测定水中溶氧偏高的是(BC )
(4)水中溶氧量为 42.88mg/L水。
Ⅱ(1)该实验装置设计中缺少的仪器的名称为略
(2)若实验测得放出热量为1.43kJ,写出表示中和热的热化学方程式略-57.2kJ/mol
(3)改用60.0mL0.5mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量 不等,所求中和热数值 相 等。(填“相等,不相等”)
解析

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案(6分)下列说法正确的是 (填序号)。
①由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
②水的沸点是100℃,酒精的沸点是78.5℃,用直接蒸馏法能使含水酒精变为无水酒精
③由于胶粒的直径比离子大,所以淀粉溶液中混有的碘化钾可用渗析法分离
④分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现
⑤由于高级脂肪酸钠盐在水中的分散质微粒直径在1nm~100 nm之间,所以可用食盐使高级脂肪酸纳从皂化反应后的混合物中析出
⑥不慎把苯酚溶液沾到皮肤上,应立即用酒精洗涤
⑦用稀溴水滴入苯酚溶液中制备2,4,6-三溴苯酚
⑧实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃
17..(18分)某化学小组采用类似制乙酸乙酯的装置(如右图),以环己醇制备环己烯:
 已知:
已知: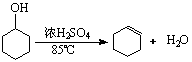
| 密度 | 熔点 | 沸点 | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,
导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
 (2)制备精品
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和
食盐水,振荡、静置、分层,环己烯在 层(填
“上”或“下”),分液后用 (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
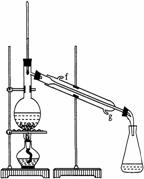
②再将环己烯按右图装置蒸馏,冷却水从 口进入。
蒸馏时要加入生石灰,目的是: 。
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 ( )
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 ( )
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
18.(12分)有机
物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
(6)写出D与NaOH溶液共热反应的化学方程式
。
19.(16分)肉
桂酸甲酯(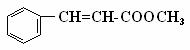 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精
⑴肉桂酸甲酯的分子式是 ;
 ⑵下列有关肉桂酸甲酯的叙述中,正确的是 填字母);
⑵下列有关肉桂酸甲酯的叙述中,正确的是 填字母);
A.能与溴的四氯化碳溶液发生加成反应
B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应
D.不可能发生加聚反应
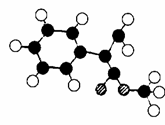
⑶G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。则G的结构简式为 ;
⑷用芳香烃A为原料合成G的路线如下:

①化合物E中的官能团有 (填名称)。
②F→G的反应类型是 ,该反应的化学方程式为 _ _ 。
③C→D的化学方程式为 _。
④写出符合下列条件的F的同分异构体的结构简式 。O%M
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。
20.(10分)有机物A的蒸汽对同温同压下氢气的相对密度为31,取3.1克A物质在足量氧气中充分燃烧,只生成2.7克水和标准状况下CO22.24L,求有机物的分子式;若该有机物0.2mol恰好与9.2克金属钠完全反应,请写出有机物的结构简式并命名。