摘要:① Mg.Al ② 镁, b.c
网址:http://m.1010jiajiao.com/timu3_id_52474[举报]
下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
(1)请写出h元素的价电子排布图
 ;
;
(2)ya3分子的电子式是
 ,其分子的空间构型是
,其分子的空间构型是
(3)请写出上述元素d3+的核外电子排布式
(4)请比较b、e、j三种元素的第一电离能由大到小的顺序
查看习题详情和答案>>
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||


(2)ya3分子的电子式是


三角锥形
三角锥形
,分子中y原子的杂化轨道类型是sp3杂化
sp3杂化
,g2+可以与ya3 以配位
配位
键形成[g(ya3)4]2+离子;(3)请写出上述元素d3+的核外电子排布式
ls22s22p63s23p63d5
ls22s22p63s23p63d5
,实验室常用形成一种红色配离子的方法检验该离子,该反应的离子方程式为Fe3++3SCN-=Fe(SCN)3
Fe3++3SCN-=Fe(SCN)3
.(4)请比较b、e、j三种元素的第一电离能由大到小的顺序
Cl>Mg>Al
Cl>Mg>Al
(写元素符号),其原因是同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势.但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素
同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势.但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素
.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验.
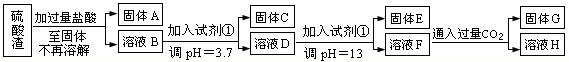
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol?L-1.请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式:
(2)上述流程中两次使用试剂①,推测试剂①应该是
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是
(4)固体E为
(5)计算溶液F中c(Mg2+)=
查看习题详情和答案>>

已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol?L-1.请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式:
SiO2+2NaOH=Na2SiO3+H2O
SiO2+2NaOH=Na2SiO3+H2O
.(2)上述流程中两次使用试剂①,推测试剂①应该是
A
A
(填以下字母编号)A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是
镁离子沉淀不完全或氢氧化铝溶解不完全等
镁离子沉淀不完全或氢氧化铝溶解不完全等
;(任写一点)(4)固体E为
Mg(OH)2
Mg(OH)2
,写出溶液F通入过量CO2生成固体G和溶液H的化学方程式:NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3
NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3
.(5)计算溶液F中c(Mg2+)=
5.6×10-10mol/L
5.6×10-10mol/L
(25℃时,氢氧化镁的Ksp=5.6×10-12)下表为元素周期表的一部分;a、b、c…为部分元素.回答下列问题:
(1)请写出上述元素d3+的核外电子排布式
(2)b的一种氧化物与a、g形成的化合物发生反应可产生气体,请写出该反应的化学方程式
(3)请比较c、e、f三种元素的电负性由大到小的顺序
(4)e、j两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、g三种元素形成的化合物反应的离子方程式
查看习题详情和答案>>
| a | |||||||||||||||||
| f | g | ||||||||||||||||
| b | c | e | h | ||||||||||||||
| d | j | ||||||||||||||||
1s22s22p63s23p63d5
1s22s22p63s23p63d5
;(2)b的一种氧化物与a、g形成的化合物发生反应可产生气体,请写出该反应的化学方程式
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;(3)请比较c、e、f三种元素的电负性由大到小的顺序
C>Al>Mg
C>Al>Mg
(写元素符号);此三种元素的第一电离能由大到小的顺序Al>C>Mg
Al>C>Mg
(写元素符号)(4)e、j两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、g三种元素形成的化合物反应的离子方程式
氢氧化镁和氢氧化铝不反应
氢氧化镁和氢氧化铝不反应
.
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si.
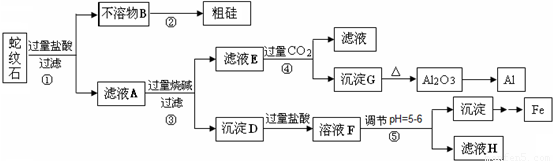
有关氢氧化物沉淀的pH见下表:
(1)写出不溶物B在生产中的一种用途:______.
(2)操作④中滤液E与过量CO2反应生成沉淀G的离子方程式为:______.
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号)______.
a. NaOH溶液 b.氨水 c. Fe2O3 d. Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:
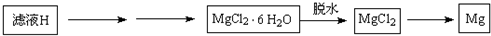
Ⅰ.流程中由滤液H中得到MgCl2?6H2O的方法是______、______、过滤、洗涤;
Ⅱ.在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是______.(应用离子方程式和简要文字说明)
Ⅲ.冶炼镁的方法用化学方程式表示为______熔融Mg+Cl2↑ 查看习题详情和答案>>

有关氢氧化物沉淀的pH见下表:
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(2)操作④中滤液E与过量CO2反应生成沉淀G的离子方程式为:______.
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号)______.
a. NaOH溶液 b.氨水 c. Fe2O3 d. Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:
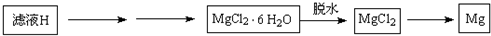
Ⅰ.流程中由滤液H中得到MgCl2?6H2O的方法是______、______、过滤、洗涤;
Ⅱ.在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是______.(应用离子方程式和简要文字说明)
Ⅲ.冶炼镁的方法用化学方程式表示为______熔融Mg+Cl2↑ 查看习题详情和答案>>
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si.
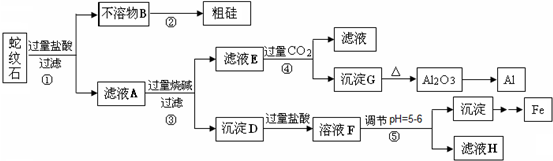
有关氢氧化物沉淀的pH见下表:
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(2)操作④中滤液E与过量CO2反应生成沉淀G的离子方程式为:______.
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号)______.
a. NaOH溶液 b.氨水 c. Fe2O3 d. Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:
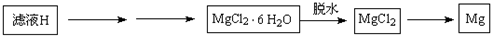
Ⅰ.流程中由滤液H中得到MgCl2?6H2O的方法是______、______、过滤、洗涤;
Ⅱ.在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是______.(应用离子方程式和简要文字说明)
Ⅲ.冶炼镁的方法用化学方程式表示为______. 查看习题详情和答案>>