摘要:10.将纯锌片和纯铜片按下图所示方式插入同深度的稀硫酸中一段时间.以下叙述正确的是 A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极.乙中铜片是负极 C.两烧杯中溶液的pH均增大 D.产生气泡的速度甲比乙慢 解析:本题考查了置换反应和原电池的有关知识. 甲中形成铜锌原电池.锌作负极.失电子.铜作正极.H+在铜极上得电子.生成H2.总反应式为:Zn + H2SO4 = ZnSO4 + H2↑.原电池的构成加快了反应速率.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn + H2SO4 = ZnSO4 + H2↑.所以甲中铜片表面有气泡产生.A不正确,乙中不构成原电池,铜片不是电极.B不正确,原电池能加快反应速率,故产生气泡的速度甲比乙快.D不正确. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_52162[举报]
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
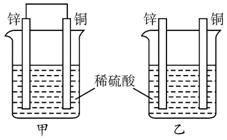
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大 D.产生气泡的速率甲比乙慢
查看习题详情和答案>>
将纯锌片和纯铜片按下图所示方式插入相同浓度的稀硫酸中一段时间,以下叙述正确的是
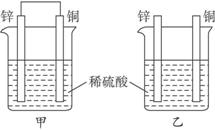
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大 D.产生气泡的速率甲比乙慢
查看习题详情和答案>>将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
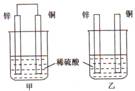 A.两烧杯中铜片表面均无气泡产生
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
查看习题详情和答案>>将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是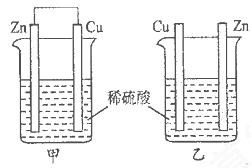
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 | D.产生气泡的速率甲比乙慢 |
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是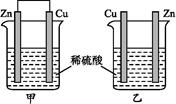
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 | D.产生气泡的速率甲比乙慢 |