摘要:15.取镁铝合金粉末若干.用足量的盐酸溶解后.再向溶液中加入过量的NaOH溶液.将生成的沉淀过滤.洗涤.灼烧.得到的白色粉末与原合金粉末质量相等.则原合金中镁的质量分数是 ( ) A.30% B.40% C.50% D.60%
网址:http://m.1010jiajiao.com/timu3_id_51910[举报]
选择题取镁铝合金粉末若干,用足量盐酸溶解后,再向溶液中加入过量NaOH溶液,将生成的沉淀过滤、洗涤、干燥后,得到的白色粉末与原合金粉末质量恰巧相等,则原合金中镁的质量百分含量为
- A.41.3%
- B.40.6%
- C.50.3%
- D.60%
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验过程(实验前已经将合金样品磨成粉末状)
(1)称取样品ag,所用称量仪器使用的第一步操作为
(2)将上述样品溶解于足量稀盐酸中,过滤,滤渣中含有
(3)在滤液中加过量NaOH溶液,过滤.
(4)在第(3)步的滤液中通入足量的CO2,充分反应后过滤,将沉淀用蒸馏水洗涤数次后,烘干灼烧至质量不再减少为止.冷却后称量,质量为bg.有关反应的离子方程式为
×100%
×100%.
(5)①若步骤(3)中NaOH溶液的量加入不足,则能使测定结果
②若步骤(4)中沉淀没有洗涤,则能使测定结果
查看习题详情和答案>>
(1)称取样品ag,所用称量仪器使用的第一步操作为
游码置零,调节天平平衡
游码置零,调节天平平衡
.(2)将上述样品溶解于足量稀盐酸中,过滤,滤渣中含有
Cu、Si
Cu、Si
.(3)在滤液中加过量NaOH溶液,过滤.
(4)在第(3)步的滤液中通入足量的CO2,充分反应后过滤,将沉淀用蒸馏水洗涤数次后,烘干灼烧至质量不再减少为止.冷却后称量,质量为bg.有关反应的离子方程式为
CO2+H20+A102-═Al(OH)3↓+HCO3-、2Al(OH)3↓
Al2O3+3H2O
| ||
CO2+H20+A102-═Al(OH)3↓+HCO3-、2Al(OH)3↓
Al2O3+3H2O
,该样品中铝的质量分数为
| ||
| 9b |
| 17a |
| 9b |
| 17a |
(5)①若步骤(3)中NaOH溶液的量加入不足,则能使测定结果
偏低
偏低
(填“偏高”、“偏低”或“不影响”,下同).②若步骤(4)中沉淀没有洗涤,则能使测定结果
偏高
偏高
.某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验过程(实验前已经将合金样品磨成粉末状)
(1)称取样品ag,所用称量仪器使用的第一步操作为______.
(2)将上述样品溶解于足量稀盐酸中,过滤,滤渣中含有______.
(3)在滤液中加过量NaOH溶液,过滤.
(4)在第(3)步的滤液中通入足量的CO2,充分反应后过滤,将沉淀用蒸馏水洗涤数次后,烘干灼烧至质量不再减少为止.冷却后称量,质量为bg.有关反应的离子方程式为______,该样品中铝的质量分数为______.
(5)①若步骤(3)中NaOH溶液的量加入不足,则能使测定结果______(填“偏高”、“偏低”或“不影响”,下同).
②若步骤(4)中沉淀没有洗涤,则能使测定结果______.
查看习题详情和答案>>
某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验过程(实验前已经将合金样品磨成粉末状)
(1)称取样品a g,称取时使用的仪器名称为 。
(2)将上述样品溶解于足量稀盐酸中,过滤,滤渣中含有
(3)在滤液中加过量NaOH溶液,过滤。
(4)在第(3)步的滤液中通入足量的CO2,充分反应后过滤,将沉淀用蒸馏水洗涤数次后烘干灼烧至质量不再减少为止。冷却后称量,质量为b g。有关反应的离子方程式为 ,该样品中铝的质量分数为
(5)①若步骤(3)中NaOH溶液的量加入不足,则能使测定结果 (填“偏高”、“偏低”或“不影响”)。
②若步骤(4)中沉淀没有洗涤,则能使测定结果 (填“偏高”、“偏低”或“不影响”)。
查看习题详情和答案>>(2013?河西区一模)铝镁合金是轮船制造、化工生产等行业的重要材料.为测定某铝镁合金(不含其它元素)中镁的质量分数,某实验小组设计了下列实验方案,每个方案均称取5.4g粉末状样品进行探究.请按要求回答下列问题:
[实验l]铝镁合金
测定剩余固体质量.
已知:试剂X焰色反应为黄色.
(1)将称量好的样品放入V1mL 2.0mol/L试剂X中,充分反应.此反应的离子方程式为
(2)经过滤、干燥、称量固体,测得镁的质量分数
[实验2]铝镁合金
测定数据
(l)欲计算镁的质量分数,该实验还需测定的数据是
(2)若用空气代替O2进行实验,则测定镁的质量分数将
Mg3N2]
[实验3]铝镁合金
测定生成无色气体的体积
实验装置如下图:
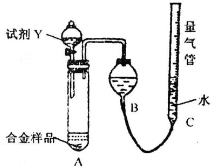
(1)该实验在盛装药品之前应首先进行的实验步骤是
(2)同学甲选定试剂Y进行实验,当发现装置A中样品迅速溶解完全后,立即调整量气管C中液面与B中液面相平,测得产生气体体积为V2L[已折算为标准状况下,A中液体体积忽略不计,下述(3)中同].试剂Y的名称是
(3)同学乙将试剂Y换为实验1中的试剂X,假设操作均正确,充分反应后测得产生气体体积为V3L,则镁的质量分数为
×100%
×100%(含V3的表达式).
查看习题详情和答案>>
[实验l]铝镁合金
| 足量试剂X |
已知:试剂X焰色反应为黄色.
(1)将称量好的样品放入V1mL 2.0mol/L试剂X中,充分反应.此反应的离子方程式为
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
;V1的取值范围是≥100mL
≥100mL
mL.(2)经过滤、干燥、称量固体,测得镁的质量分数
偏高
偏高
(填“偏高”或“无影响”或“偏低”),其原因是过滤后没有洗涤
过滤后没有洗涤
.[实验2]铝镁合金
| 足量O2充分灼烧 |
| 密封(容器带自由移动的活塞) |
(l)欲计算镁的质量分数,该实验还需测定的数据是
灼烧后固体的质量
灼烧后固体的质量
.(2)若用空气代替O2进行实验,则测定镁的质量分数将
偏高
偏高
填“偏高”或“无影响”或“偏低”).[已知:3Mg+N2
| ||
[实验3]铝镁合金
| 足量试剂Y |
实验装置如下图:

(1)该实验在盛装药品之前应首先进行的实验步骤是
检查装置的气密性
检查装置的气密性
.(2)同学甲选定试剂Y进行实验,当发现装置A中样品迅速溶解完全后,立即调整量气管C中液面与B中液面相平,测得产生气体体积为V2L[已折算为标准状况下,A中液体体积忽略不计,下述(3)中同].试剂Y的名称是
稀盐酸或稀硫酸
稀盐酸或稀硫酸
.所测镁的质量分数偏低的理由是放热反应,温度升高,测定的氢气的体积偏大,又Al的含量越大,生成氢气越多,则氢气的体积大时计算出Mg的质量分数偏低
放热反应,温度升高,测定的氢气的体积偏大,又Al的含量越大,生成氢气越多,则氢气的体积大时计算出Mg的质量分数偏低
.(3)同学乙将试剂Y换为实验1中的试剂X,假设操作均正确,充分反应后测得产生气体体积为V3L,则镁的质量分数为
| 1-V3 |
| 6.72 |
| 1-V3 |
| 6.72 |