摘要:将aL含(NH4)2SO4与NH4NO3的混合液平均分成两份.向一份中加入b mol烧碱.加热恰好将其中NH3全部赶出.向另一份中加入BaCl2溶液完全反应.消耗c mol BaCl2.原溶液中NO3-的物质的量浓度为 .
网址:http://m.1010jiajiao.com/timu3_id_51273[举报]
|
将NaOH溶液加入到13.2 g含有(NH4)2SO4与(NH4)2CO3的固体混合物中,充分反应后,可收集到密度为17 g/22.4 L的气体体积不可能是 | |
A. |
4.68 L |
B. |
4.3 L |
C. |
6.16 L |
D. |
5.2 L |
(2013?兰州一模)[化学--选修2 化学与技术]
活性ZnO在橡胶、塑料、涂料工业中有广泛的应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下:
已知:
(1)碱式碳酸锌(Zn2 (OH)2CO3)经焙烧可制得活性ZnO
(2)几种离子生成氢氧化物沉淀时的pH如下表:
请问答下列问题:
(1)浸出过程中提高浸出效率可采用的措施有
(2)步骤A加H2O2发生反应的离子方程式是
(3)步骤B进行的操作名称是
(4)A溶液中主要含有的溶质是
查看习题详情和答案>>
活性ZnO在橡胶、塑料、涂料工业中有广泛的应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下:

已知:
(1)碱式碳酸锌(Zn2 (OH)2CO3)经焙烧可制得活性ZnO
(2)几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
(1)浸出过程中提高浸出效率可采用的措施有
将粗ZnO矿石粉碎或提高浸取温度或适当增加酸的浓度等
将粗ZnO矿石粉碎或提高浸取温度或适当增加酸的浓度等
(任答一条即可).(2)步骤A加H2O2发生反应的离子方程式是
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
,该步骤需控制溶液pH的范围是3.2~5.2
3.2~5.2
.(3)步骤B进行的操作名称是
沉降、过滤
沉降、过滤
.步骤C中加入锌粉的目的是除去溶液中的Cu2+杂质
除去溶液中的Cu2+杂质
.(4)A溶液中主要含有的溶质是
(NH4)2SO4
(NH4)2SO4
,生成碱式碳酸锌的离子反应的方程式为2Zn2++4HCO3-═Zn2 (OH)2CO3↓+3CO2↑+H2O
2Zn2++4HCO3-═Zn2 (OH)2CO3↓+3CO2↑+H2O
.
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4?FeSO4?6H2O,商品名称为莫尔盐,是一种复盐.一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定.与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体.三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品:Fe屑(含少量碳)、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇.
实验步骤流程图:
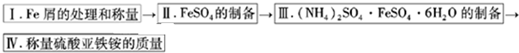
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是 ,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入 g(用含m1和m2的代数式表示,要求化简,下同.)水配制成室温下(20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.放置冷却,得到硫酸亚铁铵的晶体,过滤后用 洗涤晶体.
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4?FeSO4?6H2O的质量分数?(列式计算) 查看习题详情和答案>>
| 温度/℃ | FeSO4?7H2O | (NH4)2SO4 | (NH4)2SO4?FeSO4?6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
实验步骤流程图:

请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4?FeSO4?6H2O的质量分数?(列式计算) 查看习题详情和答案>>
(2009?辽宁模拟)为了除去工业废气中的SO2,防止造成环境污染,现查得一份将SO2转化为(NH4)2SO4的资料.摘要如下:
“一个典型实验:初步处理后的废气中含0.2%的SO2和10%的O2(体积含量),在400℃时废气以5m3/h的速率通过V2O5催化剂层与20L/h速率的NH3混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到(NH4)2SO4晶体.”(气体体积均已折算为标准状况)仔细阅读上文,回答下列问题:
(1)按反应中的理论值,SO2和O2的物质的量之比为2:1,该资料中这个比值是多少?为什么?
(2)通过计算说明为什么废气以5m3/h的速率与20L/h速率的NH3混合?
(3)若某厂每天排放10000m3这种废气,按上述方法该厂每月(按30天计算)可得(NH4)2SO4多少吨?消耗NH3多少吨?
查看习题详情和答案>>
“一个典型实验:初步处理后的废气中含0.2%的SO2和10%的O2(体积含量),在400℃时废气以5m3/h的速率通过V2O5催化剂层与20L/h速率的NH3混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到(NH4)2SO4晶体.”(气体体积均已折算为标准状况)仔细阅读上文,回答下列问题:
(1)按反应中的理论值,SO2和O2的物质的量之比为2:1,该资料中这个比值是多少?为什么?
(2)通过计算说明为什么废气以5m3/h的速率与20L/h速率的NH3混合?
(3)若某厂每天排放10000m3这种废气,按上述方法该厂每月(按30天计算)可得(NH4)2SO4多少吨?消耗NH3多少吨?
下表是工业上除去燃煤烟气中二氧化硫的3种方法.
(1)方法1中,氨水吸收燃煤烟气中SO2的化学反应为:2NH3?H2O+SO2═(NH4)2SO3+H2O
下列措施一定能提高除去燃煤烟气中SO2速率的是 (填字母).
a.增大氨水浓度 b.升高反应温度 c.氨水以雾状与烟气混合接触
(2)方法2中,当含SO2的废气与O2被活性炭吸附时,发生反应:
2SO2(g)+O2(g)?2SO3(g)△H<O
为研究此反应,将SO2和O2放入容积固定的密闭容器中,一定条件下反应物浓度随时间变化如下表:
①反应2min内的平均反应速率v(SO3)= ;该条件下,此反应化学平衡常数K的值为 .
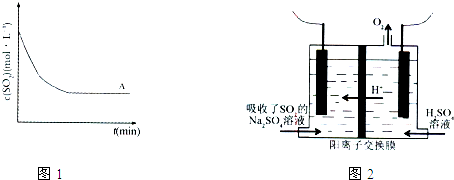
②上述条件(称为条件A)下,SO2的浓度随时间变化的曲线,如图1曲线所示.与条件A相比,条件B仅降低温度,条件C仅改用高效催化剂,请在图1中分别绘出条件B、条件C时,SO2浓度随时间变化的两条曲线.
(3)方法3中,用惰性电极电解的装置如图2.电解总反应为:H2SO3
O2↑+S↓+H2O
①该电解池阳极的电极反应式为 ,硫单质将在 得到(填“阴极”或“阳极”).
②若电解效率=实际产量/理论产量×100%,当电解吸收了池外电路通过2.00×10-2mol的电子时,收集到硫单质0.144g,则电解效率为 .
查看习题详情和答案>>
| 方法1 | 用氨水将SO2转化为(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法2 | 用活性炭吸附法处理SO2 |
| 方法3 | 用Na2SO4溶液吸收SO2,再进行电解得到S单质 |
下列措施一定能提高除去燃煤烟气中SO2速率的是
a.增大氨水浓度 b.升高反应温度 c.氨水以雾状与烟气混合接触
(2)方法2中,当含SO2的废气与O2被活性炭吸附时,发生反应:
2SO2(g)+O2(g)?2SO3(g)△H<O
为研究此反应,将SO2和O2放入容积固定的密闭容器中,一定条件下反应物浓度随时间变化如下表:
| t(min) 浓度(mol?L-1) |
0min | 1min | 2min | 3min | 4min | 5min | 6min |
| c(SO2) | 0.054 | 0.034 | 0.018 | 0.010 | 0.008 | 0.006 | 0.006 |
| c(O2) | 0.032 | 0.022 | 0.014 | 0.010 | 0.009 | 0.008 | 0.008 |
②上述条件(称为条件A)下,SO2的浓度随时间变化的曲线,如图1曲线所示.与条件A相比,条件B仅降低温度,条件C仅改用高效催化剂,请在图1中分别绘出条件B、条件C时,SO2浓度随时间变化的两条曲线.
(3)方法3中,用惰性电极电解的装置如图2.电解总反应为:H2SO3
| ||
①该电解池阳极的电极反应式为
②若电解效率=实际产量/理论产量×100%,当电解吸收了池外电路通过2.00×10-2mol的电子时,收集到硫单质0.144g,则电解效率为
