题目内容
下表是工业上除去燃煤烟气中二氧化硫的3种方法.
(1)方法1中,氨水吸收燃煤烟气中SO2的化学反应为:2NH3?H2O+SO2═(NH4)2SO3+H2O
下列措施一定能提高除去燃煤烟气中SO2速率的是 (填字母).
a.增大氨水浓度 b.升高反应温度 c.氨水以雾状与烟气混合接触
(2)方法2中,当含SO2的废气与O2被活性炭吸附时,发生反应:
2SO2(g)+O2(g)?2SO3(g)△H<O
为研究此反应,将SO2和O2放入容积固定的密闭容器中,一定条件下反应物浓度随时间变化如下表:
①反应2min内的平均反应速率v(SO3)= ;该条件下,此反应化学平衡常数K的值为 .
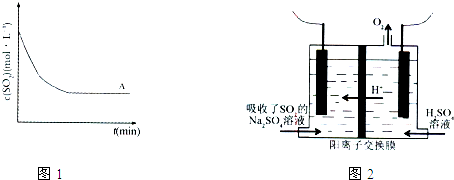
②上述条件(称为条件A)下,SO2的浓度随时间变化的曲线,如图1曲线所示.与条件A相比,条件B仅降低温度,条件C仅改用高效催化剂,请在图1中分别绘出条件B、条件C时,SO2浓度随时间变化的两条曲线.
(3)方法3中,用惰性电极电解的装置如图2.电解总反应为:H2SO3
O2↑+S↓+H2O
①该电解池阳极的电极反应式为 ,硫单质将在 得到(填“阴极”或“阳极”).
②若电解效率=实际产量/理论产量×100%,当电解吸收了池外电路通过2.00×10-2mol的电子时,收集到硫单质0.144g,则电解效率为 .
| 方法1 | 用氨水将SO2转化为(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法2 | 用活性炭吸附法处理SO2 |
| 方法3 | 用Na2SO4溶液吸收SO2,再进行电解得到S单质 |
下列措施一定能提高除去燃煤烟气中SO2速率的是
a.增大氨水浓度 b.升高反应温度 c.氨水以雾状与烟气混合接触
(2)方法2中,当含SO2的废气与O2被活性炭吸附时,发生反应:
2SO2(g)+O2(g)?2SO3(g)△H<O
为研究此反应,将SO2和O2放入容积固定的密闭容器中,一定条件下反应物浓度随时间变化如下表:
| t(min) 浓度(mol?L-1) |
0min | 1min | 2min | 3min | 4min | 5min | 6min |
| c(SO2) | 0.054 | 0.034 | 0.018 | 0.010 | 0.008 | 0.006 | 0.006 |
| c(O2) | 0.032 | 0.022 | 0.014 | 0.010 | 0.009 | 0.008 | 0.008 |
②上述条件(称为条件A)下,SO2的浓度随时间变化的曲线,如图1曲线所示.与条件A相比,条件B仅降低温度,条件C仅改用高效催化剂,请在图1中分别绘出条件B、条件C时,SO2浓度随时间变化的两条曲线.
(3)方法3中,用惰性电极电解的装置如图2.电解总反应为:H2SO3
| ||
①该电解池阳极的电极反应式为
②若电解效率=实际产量/理论产量×100%,当电解吸收了池外电路通过2.00×10-2mol的电子时,收集到硫单质0.144g,则电解效率为

分析:(1)依据影响化学反应速率的因素分析判断;
(2)①依据图表数据结合化学反应速率和化学平衡常数的概念分析计算得到;
②条件B仅降低温度,反应速率减小,达到平衡所需时间增长,反应是放热反应,降温平衡正向进行,二氧化硫的浓度小于A状态时的二氧化硫浓度,条件C仅改用高效催化剂,加快反应速率,达到平衡所需时间减小,但不改变平衡,和A达到相同平衡状态,二氧化硫浓度相同;据此画出对应图象;
(3)①依据电池反应阳极上是氢氧根离子失电子生成氧气的反应,亚硫酸在阴极被还原为硫单质;
②依据电子守恒结合化学方程式计算理论值,依据电解效率=实际产量/理论产量×100%计算得到.
(2)①依据图表数据结合化学反应速率和化学平衡常数的概念分析计算得到;
②条件B仅降低温度,反应速率减小,达到平衡所需时间增长,反应是放热反应,降温平衡正向进行,二氧化硫的浓度小于A状态时的二氧化硫浓度,条件C仅改用高效催化剂,加快反应速率,达到平衡所需时间减小,但不改变平衡,和A达到相同平衡状态,二氧化硫浓度相同;据此画出对应图象;
(3)①依据电池反应阳极上是氢氧根离子失电子生成氧气的反应,亚硫酸在阴极被还原为硫单质;
②依据电子守恒结合化学方程式计算理论值,依据电解效率=实际产量/理论产量×100%计算得到.
解答:解:(1)一定能提高除去燃煤烟气中SO2速率的是
a.增大氨水浓度,会吸收更多的二氧化硫,提高除去速率,故a符合;
b.升高反应温度,生成亚硫酸铵会分解,减小二氧化硫的除去速率,故b不符合;
c.氨水以雾状与烟气混合接触,增大接触面积使反应更充分,故c符合;
故答案为:ac;
(2)①依据图表数据可知,
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.054 0.032 0
变化量(mol/L) 0.036 0.018 0.036
2min(mol/L) 0.018 0.014 0.036
反应2min内的平均反应速率v(SO3)=
=0.018mol/L?min;
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.054 0.032 0
变化量(mol/L) 0.048 0.024 0.048
平衡量(mol/L) 0.006 0.008 0.048
平衡常数K=
=8000;
故答案为:0.018mol?L-1?min;8000;
②条件B仅降低温度,反应速率减小,达到平衡所需时间增长,反应是放热反应,降温平衡正向进行,二氧化硫的浓度小于A状态时的二氧化硫浓度,条件C仅改用高效催化剂,加快反应速率,达到平衡所需时间减小,但不改变平衡,和A达到相同平衡状态,二氧化硫浓度相同,画出的图象为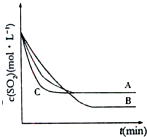 ,
,
故答案为: ;
;
(3)①电池反应阳极上是氢氧根离子失电子生成氧气的反应,电极反应为:4OH--4e-═2H2O+O2↑,亚硫酸在阴极被还原为硫单质阴极,
故答案为:4OH--4e-═2H2O+O2↑;阴极;
②当电解吸收了池外电路通过2.00×10-2mol的电子时,依据化学方程式H2SO3
O2↑+S↓+H2O,通过4mol电子生成单质硫1mol,通过2.00×10-2mol的电子时,生成硫单质0.005mol,硫单质质量=0.005mol×32g/mol=0.16g,
依据收集到硫单质0.144g,电解效率=
×100%=90%,
故答案为:90%.
a.增大氨水浓度,会吸收更多的二氧化硫,提高除去速率,故a符合;
b.升高反应温度,生成亚硫酸铵会分解,减小二氧化硫的除去速率,故b不符合;
c.氨水以雾状与烟气混合接触,增大接触面积使反应更充分,故c符合;
故答案为:ac;
(2)①依据图表数据可知,
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.054 0.032 0
变化量(mol/L) 0.036 0.018 0.036
2min(mol/L) 0.018 0.014 0.036
反应2min内的平均反应速率v(SO3)=
| 0.036mol/L |
| 2min |
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.054 0.032 0
变化量(mol/L) 0.048 0.024 0.048
平衡量(mol/L) 0.006 0.008 0.048
平衡常数K=
| 0.0482 |
| 0.0062×0.008 |
故答案为:0.018mol?L-1?min;8000;
②条件B仅降低温度,反应速率减小,达到平衡所需时间增长,反应是放热反应,降温平衡正向进行,二氧化硫的浓度小于A状态时的二氧化硫浓度,条件C仅改用高效催化剂,加快反应速率,达到平衡所需时间减小,但不改变平衡,和A达到相同平衡状态,二氧化硫浓度相同,画出的图象为
 ,
,故答案为:
 ;
;(3)①电池反应阳极上是氢氧根离子失电子生成氧气的反应,电极反应为:4OH--4e-═2H2O+O2↑,亚硫酸在阴极被还原为硫单质阴极,
故答案为:4OH--4e-═2H2O+O2↑;阴极;
②当电解吸收了池外电路通过2.00×10-2mol的电子时,依据化学方程式H2SO3
| ||
依据收集到硫单质0.144g,电解效率=
| 0.144g |
| 0.16g |
故答案为:90%.
点评:本题考查了电解原理的分析应用,化学平衡影响因素的分析判断,化学反应速率、平衡常数的概念计算应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目