摘要:硝酸的工业制法 氨氧化生成一氧化氮 两个阶段 一氧化氮氧化生成二氧化氮.二氮化氮被水吸收而生成硝酸 反应方程式: 4NH3(气)+5O2(气) 催化剂 4NO(气)+6H2O(气)+907KJ 2NO(气)+O2(气)= 2NO2(气)+113kJ 3NO2(气)+ H2O(液)= 2HNO3+136KJ 设备:氧化炉.吸收塔 吸收剂:水或稀硝酸 浓缩剂:硝酸镁或浓硫酸 尾气吸收剂:氢氧化钠溶液.(NO+NO2+NaOH=2NaNO2+H2O) 注意点:在吸收反应进行过程中补充一些空气.使吸收生成的NO再氧化为NO2.NO2 溶于水又生成HNO3和NO.经过多次的氧化和吸收.二氧化氮可以完全地被水吸收.能够尽可能多地转化为硝酸.因此起始物和反应终产物物质的量间关系为:1molNH3 转化 1molHNO3.
网址:http://m.1010jiajiao.com/timu3_id_51231[举报]
硝酸的工业制法是用氨氧化法制取,其法以氨和空气为原料,在催化剂的作用下,最后在吸收塔中用水吸收制取硝酸.其具体的工艺流程如下:
请回答下列问题:
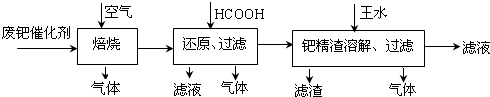
(1)从吸收塔中出来的硝酸浓度大约是50%,不能直接用于军工、染料等工业,必须将其进入蒸馏塔制成98%以上的浓硝酸.某中学实验小组,在实验室模拟蒸馏塔中对稀硝酸蒸馏时应注意选择适宜的条件是 .原因是 .(请用化学方程式解释之)
(2)在氧化炉中只发生主反应①和副反应②
4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-905kJ?mol-1①
4NH3(g)+3O2(g)?2N2(g)+6H2O(g);△H=-1268kJ?mol-1②
试写出N2氧化为NO的热化学方程式 ;
(3)在氧化炉中催化氧化时,有关物质的产率与温度的关系如下图:
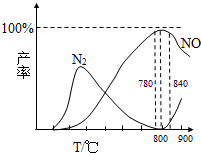
据图可知工业上氨催化氧化生成NO时,应该控制温度在 左右,该反应所使用的催化剂是 .
温度高于900℃时,NO产率下降的可能原因是
.
(4)从氧化炉中出来的气体为什么不直接进入吸收塔,而是进入热交换器?这样做的优点是 .
(5)下列措施可提高氨催化氧化生成NO的产率的是 .
A.降低反应体系的压强 B.实际生产中采用物料比n(O2)/n(NH3)为1.7~2.0
C.研究开发使用效果更好的催化剂 D.升高反应体系的温度. 查看习题详情和答案>>
请回答下列问题:

(1)从吸收塔中出来的硝酸浓度大约是50%,不能直接用于军工、染料等工业,必须将其进入蒸馏塔制成98%以上的浓硝酸.某中学实验小组,在实验室模拟蒸馏塔中对稀硝酸蒸馏时应注意选择适宜的条件是
(2)在氧化炉中只发生主反应①和副反应②
4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-905kJ?mol-1①
4NH3(g)+3O2(g)?2N2(g)+6H2O(g);△H=-1268kJ?mol-1②
试写出N2氧化为NO的热化学方程式
(3)在氧化炉中催化氧化时,有关物质的产率与温度的关系如下图:

据图可知工业上氨催化氧化生成NO时,应该控制温度在
温度高于900℃时,NO产率下降的可能原因是
(4)从氧化炉中出来的气体为什么不直接进入吸收塔,而是进入热交换器?这样做的优点是
(5)下列措施可提高氨催化氧化生成NO的产率的是
A.降低反应体系的压强 B.实际生产中采用物料比n(O2)/n(NH3)为1.7~2.0
C.研究开发使用效果更好的催化剂 D.升高反应体系的温度. 查看习题详情和答案>>
工业上用氨的催化氧化法制硝酸时,先制成50%左右的硝酸,然后再制成96%的浓硝酸,一般采用的方法是
- A.加CaCl2后再蒸馏浓缩
- B.加生石灰吸去水后再过滤
- C.加硝酸镁后再蒸馏浓缩
- D.加入浓H2SO4后再分液
|
工业上用氨的催化氧化法制HNO3时,先制得50%左右的硝酸,然后再制成96%的浓HNO3,一般采用的方法是 | |
| [ ] | |
A. |
加CaCl2后再蒸馏浓缩 |
B. |
加生石灰吸去水分后再过滤 |
C. |
加硝酸镁后再蒸馏浓缩 |
D. |
加入浓H2SO4后再分液 |
 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②下列说法中正确的是( )
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图.4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1 ①4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ?mol-1 ②下列说法中正确的是( )