题目内容
工业上利用氨催化氧化法可制取硝酸,加入脱水剂后制得较高浓度的硝酸.以17吨氨作为原料,假设NH3全部转化为HNO3.
(1)写出NH3完全转化为HNO3的总化学反应方程式
(2)生产过程中需加水吸收,如果与加入脱水剂后脱去水的量相等,则所得硝酸溶液的质量分数为多少?
(3)如果生产中同时制得50%的硝酸m1吨和90%的硝酸m2吨(脱去的水可循环使用,制得较低浓度的稀硝酸),若共加入27吨水,请问m1与m2的质量之比为多少?(要有简单的计算过程)
(1)写出NH3完全转化为HNO3的总化学反应方程式
NH3+2O2=HNO3+H2O
NH3+2O2=HNO3+H2O
(2)生产过程中需加水吸收,如果与加入脱水剂后脱去水的量相等,则所得硝酸溶液的质量分数为多少?
(3)如果生产中同时制得50%的硝酸m1吨和90%的硝酸m2吨(脱去的水可循环使用,制得较低浓度的稀硝酸),若共加入27吨水,请问m1与m2的质量之比为多少?(要有简单的计算过程)
分析:(1)氨催化氧化法制硝酸的步骤:氨气催化氧化为一氧化氮、一氧化氮和氧气反应生成二氧化氮、二氧化氮和水反应生成硝酸;
(2)根据化学方程的含义进行计算;
(3)根据反应原理结合题干已知数据进行计算.
(2)根据化学方程的含义进行计算;
(3)根据反应原理结合题干已知数据进行计算.
解答:解:(1)氨催化氧化法制硝酸的步骤:氨气催化氧化为一氧化氮、一氧化氮和氧气反应生成二氧化氮、二氧化氮和水反应生成硝酸,将以上步骤合并得到:NH3+2O2=HNO3+H2O,
故答案为:NH3+2O2=HNO3+H2O;
(2)根据化学方程式:NH3+2O2=HNO3+H2O,生产过程中需加水的量与加入脱水剂后脱去水的量相等,则硝酸的质量分数=
×100%=
×100%=77.8%.
答:所得硝酸溶液的质量分数为77.8%;
(3)根据化学方程式:NH3+2O2=HNO3+H2O,同时制得50%的硝酸m1吨和90%的硝酸m2吨时,则
硝酸质量关系:0.5m1+0.9m2=63
水的质量关系:0.5m1+(1-0.9)m2=27+18
解得:m1=85.5吨、m2=22.5吨,
所以
=
,
答:m1与m2的质量之比为19:5.
故答案为:NH3+2O2=HNO3+H2O;
(2)根据化学方程式:NH3+2O2=HNO3+H2O,生产过程中需加水的量与加入脱水剂后脱去水的量相等,则硝酸的质量分数=
| 硝酸质量 |
| 硝酸质量+水的质量 |
| 63t |
| 63t+18t |
答:所得硝酸溶液的质量分数为77.8%;
(3)根据化学方程式:NH3+2O2=HNO3+H2O,同时制得50%的硝酸m1吨和90%的硝酸m2吨时,则
硝酸质量关系:0.5m1+0.9m2=63
水的质量关系:0.5m1+(1-0.9)m2=27+18
解得:m1=85.5吨、m2=22.5吨,
所以
| m1 |
| m2 |
| 19 |
| 5 |
答:m1与m2的质量之比为19:5.
点评:本题是一道化学知识和工业知识相结合的题目,是一道综合知识的考查,难度较大.

练习册系列答案
相关题目
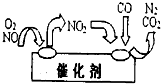 工业上利用氨催化氧化后,经过一系列反应可以制备硝酸.
工业上利用氨催化氧化后,经过一系列反应可以制备硝酸.
