题目内容
硝酸的工业制法是用氨氧化法制取,其法以氨和空气为原料,在催化剂的作用下,最后在吸收塔中用水吸收制取硝酸.其具体的工艺流程如下:请回答下列问题:
(1)从吸收塔中出来的硝酸浓度大约是50%,不能直接用于军工、染料等工业,必须将其进入蒸馏塔制成98%以上的浓硝酸.某中学实验小组,在实验室模拟蒸馏塔中对稀硝酸蒸馏时应注意选择适宜的条件是
(2)在氧化炉中只发生主反应①和副反应②
4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-905kJ?mol-1①
4NH3(g)+3O2(g)?2N2(g)+6H2O(g);△H=-1268kJ?mol-1②
试写出N2氧化为NO的热化学方程式
(3)在氧化炉中催化氧化时,有关物质的产率与温度的关系如下图:
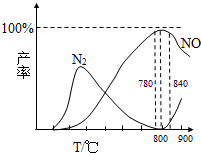
据图可知工业上氨催化氧化生成NO时,应该控制温度在
温度高于900℃时,NO产率下降的可能原因是
(4)从氧化炉中出来的气体为什么不直接进入吸收塔,而是进入热交换器?这样做的优点是
(5)下列措施可提高氨催化氧化生成NO的产率的是
A.降低反应体系的压强 B.实际生产中采用物料比n(O2)/n(NH3)为1.7~2.0
C.研究开发使用效果更好的催化剂 D.升高反应体系的温度.
分析:(1)硝酸化学性质不稳定,见光或受热分解;
(2)由盖斯定律,(①-②)×
可得目标热化学方程式,据此计算;
(3)从转化率的大小与温度的关系选择反应的适宜温度;根据外界条件对化学平衡的影响分析NO产率下降的可能原因;
(4)一氧化氮和氧气反应为放热反应,结合节约能源进行解答;
(5)根据外界条件对氨催化氧化生成NO的化学平衡的影响分析;
(2)由盖斯定律,(①-②)×
| 1 |
| 2 |
(3)从转化率的大小与温度的关系选择反应的适宜温度;根据外界条件对化学平衡的影响分析NO产率下降的可能原因;
(4)一氧化氮和氧气反应为放热反应,结合节约能源进行解答;
(5)根据外界条件对氨催化氧化生成NO的化学平衡的影响分析;
解答:解:(1)硝酸热稳定性差,见光或受热分解4HNO3
4NO2↑+O2↑+2H2O,在实验室模拟蒸馏塔中对稀硝酸蒸馏时应注意选择适宜的条件是在低温条件下,
故答案为:在低温条件下;4HNO3
4NO2↑+O2↑+2H2O;
(2)由盖斯定律,(①-②)×
可得N2(g)+O2(g)?2NO(g),故△H=
×[(-905kJ/mol)-(-1258kJ/mol)]=+181.5 kJ/mol,所以N2氧化为NO的热化学方程式为N2(g)+O2(g)═2NO(g)△H=+181.5 kJ?mol-1,
故答案为:N2(g)+O2(g)═2NO(g)△H=+181.5 kJ?mol-1;
(3)从图象可以看在,反应温度在780~840℃,NO的产率最大,故选择800℃左右,该反应所使用的催化剂是铂或铂铑合金,
故答案为:800℃;铂或铂铑合金;
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-905kJ?mol-1该反应是放热反应,温度升高平衡向逆反应方向移动,NO产率下降,
故答案为:由于生成NO的反应是放热反应,温度升高平衡向逆反应方向移动,故转化率降低;
②由图可知,温度高于900℃时,4NH3+3O2?2N2+6H2O,生成N2的副反应增多,NO产率下降,
故答案为:由图可知,温度高于900℃时,生成N2的副反应增多.故NO产率降低;
(4)2NO+O2=2NO2,该反应是放热反应,从氧化炉中出来的气体进入热交换器,这样做既可以降低NO和O2混合气的温度,又可以预热NH3和空气,达到节约能源的目的,
故答案为:这样做既可以降低NO和O2混合气的温度,又可以预热NH3和空气,达到节约能源的目的;
(5)4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-905kJ?mol-1该反应是气体体积增大的、放热的反应,为了提高氨催化氧化生成NO的产率,需使化学平衡向正反应方向移动,可采取减小压强、降低温度、增大NH3的浓度,
故答案为:A、B;
| ||
故答案为:在低温条件下;4HNO3
| ||
(2)由盖斯定律,(①-②)×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:N2(g)+O2(g)═2NO(g)△H=+181.5 kJ?mol-1;
(3)从图象可以看在,反应温度在780~840℃,NO的产率最大,故选择800℃左右,该反应所使用的催化剂是铂或铂铑合金,
故答案为:800℃;铂或铂铑合金;
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-905kJ?mol-1该反应是放热反应,温度升高平衡向逆反应方向移动,NO产率下降,
故答案为:由于生成NO的反应是放热反应,温度升高平衡向逆反应方向移动,故转化率降低;
②由图可知,温度高于900℃时,4NH3+3O2?2N2+6H2O,生成N2的副反应增多,NO产率下降,
故答案为:由图可知,温度高于900℃时,生成N2的副反应增多.故NO产率降低;
(4)2NO+O2=2NO2,该反应是放热反应,从氧化炉中出来的气体进入热交换器,这样做既可以降低NO和O2混合气的温度,又可以预热NH3和空气,达到节约能源的目的,
故答案为:这样做既可以降低NO和O2混合气的温度,又可以预热NH3和空气,达到节约能源的目的;
(5)4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-905kJ?mol-1该反应是气体体积增大的、放热的反应,为了提高氨催化氧化生成NO的产率,需使化学平衡向正反应方向移动,可采取减小压强、降低温度、增大NH3的浓度,
故答案为:A、B;
点评:本题考查硝酸的工业制法,涉及反应热的计算、化学平衡影响因素等,题目较为综合,掌握盖斯定律的运用和影响平衡的因素是解答的关键,题目难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目