网址:http://m.1010jiajiao.com/timu3_id_51153[举报]
(1)写出F元素基态原子的核外电子排布式
(2)B、C、D三种元素电负性由大到小的顺序是
(3)下列有关上述元素的说法,正确的是
①CA3沸点高于BA4,主要是因为前者相对分子质量较大②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体③C的氢化物的中心原子采取sp2杂化④F单质的熔点高于E单质,是因为F单质的金属键较强⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为
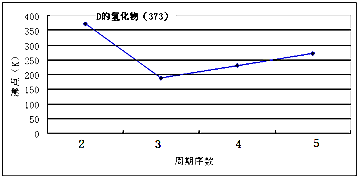
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似.ED的熔点比NaCl高,其原因是
 (1)依据第2周期元素第一电离能的变化规律,参照如图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
(1)依据第2周期元素第一电离能的变化规律,参照如图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.(2)前四周期原子序数依次增大的元素A、B、C、D中,A和B的外围电子中未成对电子均只有1个,并且A--和B+的电子数相差为8;与B位于同一周期的C和D,它们外围电子中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
①D2+的外围电子排布式为
②四种元素中第一电离能最小的是
③A-的轨道表示式
④C原子的核外电子排布式
⑤C3+的离子结构示意图
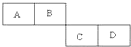 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.(1)B在元素周期表中位于
(2)A与氢元素可以形成很多化合物,在这些化合物中都含有
(3)Na 2C溶液呈碱性,其原因是
(4)用石墨电极电解NaD溶液,阴极产物是
(5)一定温度下,在密闭容器内A的单质与水蒸气发生反应生成水煤气,水蒸气的浓度变化如下图:
反应达到平衡时的平均反应速率v=

(6)B的一种氢化物B2H4可在氧气中燃烧,可制成燃料电池,电解质溶液是KOH溶液.该电池的正极的电极反应式是
[化学—物质结构与性质]
(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚( )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子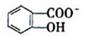 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
查看习题详情和答案>>
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1。

(1)人的汗液中台有T的简单离子,其离子结构示意图为_________________;元素M在元素周期表中的位置是___________________。
(2)R的最高价氧化物所含的化学键类型是__________键(选填“离子”或“共价”)。
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为__________(用具体的化学式表示)。
(4)在一定条件下甲、乙、丙有如下转化:甲 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
①R???? ②Q2?? ③M???? ④T2
(5)工业上,常利用。RO与MO2反应生成固态M单质和RO2,从而消除这两种气体对大气的污染。
已知:2RO(g)+O2(g)=2RO2(g)? △H=-akJ·mol-l
M(s)+O2(g)=MO2(g)????? △H=-bkJ·mol-l
则反应2RO(g)+MO2(g)=2RO2(g)+M(s)?? △H=___________。
(6)元素T的含氧酸HTO具有漂白性。往20mL 0.0lmol·L-l的HTO溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示。据此判断:该烧碱溶液的浓度为______________mol·L-l;下列有关说法正确的是_______________。

①HTO的电离常数:b点>a点
②由水电离出的c(OH—):b点<c点
③从a点到b点,混合溶液中可能存在:c(TO—)= c(Na+)
④从b点到c点,混合溶液中一直存在:c(Na+)>c(TO-)>c(OH-)>c(H+)
查看习题详情和答案>>