摘要:5.将0.4mol/LNH4Cl溶液和0.2mol/LNaOH溶液等体积混合后.溶液中下列微粒的物质的量关系正确的是 A.c(NH4+)=c(Na+)=c(OH-)>c(NH3·H2O) B.c(NH4+)=c(Na+)>c(NH3·H2O)>c(OH-)>c(H+) C.c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O) D.c(NH4+)>c(Na+)>c(NH3·H2O)>c(OH-)>c(H+)
网址:http://m.1010jiajiao.com/timu3_id_50227[举报]
 在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
0.0025mol?L-1?min-1
0.0025mol?L-1?min-1
mol?L-1?min-1.(2)n3
=
=
n4(填“>”、“<”或“=”),该反应的平衡常数的值为2.8
2.8
;(3)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
0.1mol/L
0.1mol/L
mol/L.(4)假设从放入N2O4到平衡时需要80s,请在右图中画出并标明该条件下此反应中N2O4浓度随时间变化的曲线.
(5)在(4)中条件下达到平衡后四氧化二氮的转化率为
60%
60%
,混合气体的平均摩尔质量为57.5
57.5
g.mol-1.(6)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2
 N2O4的平衡常数将
N2O4的平衡常数将减小
减小
(填“增大”、“减小”或“不变”)(7)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡2NO2
 N2O4将
N2O4将向左移动
向左移动
.(填“向左移动”、“向右移动”或“不移动”).(8)达到平衡后,如果缩小容器的体积,则气体的颜色变化是先变深后变浅,但比原来的颜色深,试用平衡移动原理解释其变化的原因
缩小容器体积,压强增大,c(NO2)的浓度变大,颜色加深;增大压强,平衡正向移动,c(NO2)的浓度减小,但比原来的浓度要大,所以看到气体颜色先变深,后变浅,但比原来深.
缩小容器体积,压强增大,c(NO2)的浓度变大,颜色加深;增大压强,平衡正向移动,c(NO2)的浓度减小,但比原来的浓度要大,所以看到气体颜色先变深,后变浅,但比原来深.
.在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)该反应的化学方程式为
(2)0~20s内N2O4的平均反应速率为
(3)在80℃时该反应的平衡常数K值为
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
A、N2O4的转化率越高 B、NO2的转化率越高
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.
查看习题详情和答案>>
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为
N2O4?2NO2
N2O4?2NO2
,(2)0~20s内N2O4的平均反应速率为
0.003mol/L?s
0.003mol/L?s
.(3)在80℃时该反应的平衡常数K值为
0.54
0.54
(保留2位小数).(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
AD
AD
.A、N2O4的转化率越高 B、NO2的转化率越高
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.
 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:(1)C在元素周期表中的位置为
(2)F单质的燃烧热△H=-akJ/mol,写出表示F单质的燃烧热的热化学方程式
(3)E单质与D的最高价氧化物的水化物的溶液反应的离子方程式为
(4)A、B两元素可形成离子化合物BA5,其电子式为
(5)将0.4mol FC2和0.2mol C2放入容积为2L的_密闭容器中,在一定条件下发生 反应2FC2+C2?2FC3,当FC2百分含量不变时,得到0.2mol FC3气体,则此时反应的平衡常数K=
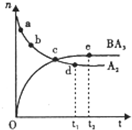
(6)向一绝热恒容密闭容器中通入B2和A2,在一定条件下发生反应B2(g)+3A2(g)?2BA3(g)△H<0,达到平衡,n(A2)和n(BA3)随时间变化的关系如图所示.下列有关叙述一定正确的是
A.c点表示BA3生成速率与BA3分解速率相等
B.c点和e点 A2的转化率相等
C.平衡后再升高温度,不利于BA3的合成
D.d点时:n(A2):n(BA3)=3:2
(7)将E元素的单质(除去氧化膜)投入浓的氯化铜溶液中,在其表面很 快出现一层红色物质,产生气体的速率逐渐加快,经检验,该气体为氢气,用温度计测得溶液的温度迅速升高.请从有关能量、是否有电化学作用等方面,分析能产生氢气且开始 阶段的速率不断加快的原因
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
(1)该反应的化学方程式为
(2)20s时,N2O4的浓度为
(3)该反应的平衡常数表达式K=
,在80℃时该反应的平衡常数K值为
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
查看习题详情和答案>>
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
N2O4?2NO2
N2O4?2NO2
,表中b>
>
c(填“<”、“=”、“>”).(2)20s时,N2O4的浓度为
0.14
0.14
mol/L,0~20s内N2O4的平均反应速率为0.003mol/L?s
0.003mol/L?s
.(3)该反应的平衡常数表达式K=
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
0.54
0.54
(保留2位小数).(4)在其他条件相同时,该反应的K值越大,表明建立平衡时
ABD
ABD
.A、N2O4的转化率越高 B、NO2的产量越大C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.(2013?辽宁一模)I.在一个容积为2L的密闭容器中加入2molN2和6molH2,发生如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,5min后达到平衡,测得c(NH3)=0.5mol/L.
(1)该条件下此反应的化学平衡常数的表达式K=
.温度升高,则K值
(2)从反应开始到平衡,用H2的浓度变化表示的反应速率为:
(3)若平衡时,移走1mol N2和3mol H2,在相同温度下再达平衡时c(NH3)
Ⅱ.25℃,将0.4mol/LCH3COOH溶液和0.2mol/LNaOH溶液各100mL混合后,pH=5.(设混合后溶液总体积为两溶液体积之和)
(1)混合溶液中离子浓度由大到小的顺序是:
(2)①c(CH3COO-)+c(CH3COOH)=
②c(CH3COO-)-c(CH3COOH)=
Ⅲ.已知25℃时,Ksp[Fe(OH)3]=8×10-39,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数为
查看习题详情和答案>>
N2(g)+3H2(g)?2NH3(g)△H<0,5min后达到平衡,测得c(NH3)=0.5mol/L.
(1)该条件下此反应的化学平衡常数的表达式K=
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
变小
变小
.(填“变大”、“变小”或“不变”)(2)从反应开始到平衡,用H2的浓度变化表示的反应速率为:
0.15mol/(L?min)
0.15mol/(L?min)
.(3)若平衡时,移走1mol N2和3mol H2,在相同温度下再达平衡时c(NH3)
<
<
0.25mol/L.(填“>”、“<”或“=”)Ⅱ.25℃,将0.4mol/LCH3COOH溶液和0.2mol/LNaOH溶液各100mL混合后,pH=5.(设混合后溶液总体积为两溶液体积之和)
(1)混合溶液中离子浓度由大到小的顺序是:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
.(2)①c(CH3COO-)+c(CH3COOH)=
0.2
0.2
moL/L②c(CH3COO-)-c(CH3COOH)=
2×(10-5-10-9)
2×(10-5-10-9)
mol/LⅢ.已知25℃时,Ksp[Fe(OH)3]=8×10-39,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数为
8×103
8×103
.(列式并计算) 向0.001mob/L FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为2.3
2.3
.(lg5=0.7)