摘要: ② 4 OH--4 e-=== 2H2O + O2↑ (2)①2 Cl-+2H2O2 OH-+H2↑+Cl2↑ ②5Cl2 + I2 + 6H2O === 10HCl + 2HIO3 ③13
网址:http://m.1010jiajiao.com/timu3_id_49803[举报]
铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图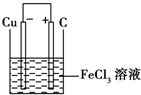
 (标出正、负极材料及电解质溶液),并写出电极反应式.正极反应
(标出正、负极材料及电解质溶液),并写出电极反应式.正极反应
(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显.请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.有关反应的化学方程式①
(4)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2.该电池正极发生的电极反应为
查看习题详情和答案>>
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
2Fe3++Cu═2Fe2++Cu2+
2Fe3++Cu═2Fe2++Cu2+
.(2)若将(1)中的反应设计成原电池,请画出原电池的装置图


2Fe3++2e-═2Fe2+或Fe3++e-═2e2+
2Fe3++2e-═2Fe2+或Fe3++e-═2e2+
,负极反应Cu-2e-═Cu2+
Cu-2e-═Cu2+
.(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显.请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.有关反应的化学方程式①
CuO+H2SO4═CuSO4+H2O
CuO+H2SO4═CuSO4+H2O
②CuSO4+Fe═FeSO4+Cu
CuSO4+Fe═FeSO4+Cu
.劣质不锈钢腐蚀的实验现象不锈钢表面有红色物质生成,溶液颜色由蓝色变成浅绿色
不锈钢表面有红色物质生成,溶液颜色由蓝色变成浅绿色
.(4)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2.该电池正极发生的电极反应为
2SOCl2+4e-═4Cl-+S+SO2
2SOCl2+4e-═4Cl-+S+SO2
.生铁中除铁外,还含有其他元素,如碳元素和硫元素.其中碳主要以碳化铁的形态存在.某兴趣小组设计按下图所示的实验装置,测定生铁中的含碳量.

请回答下列问题:
(1)硫在生铁中是有害元素,它使生铁产生热脆性.硫元素在生铁中最有可能存在的价态是
A、-2 B、0 C、+4 D、+6
(2)写出在烧杯E中发生反应的离子方程式:
(3)D中30% 双氧水的作用是
(4)反应完成后,欲验证生铁含有硫元素,你所设计的实验方案是(写出实验步骤、现象)
(5)待C管的样品充分反应后,测得E中生成的沉淀为bg,请计算出生铁中的含碳量为
%
%;
(6)实验过程中,该兴趣小组应注意的安全问题是
查看习题详情和答案>>

请回答下列问题:
(1)硫在生铁中是有害元素,它使生铁产生热脆性.硫元素在生铁中最有可能存在的价态是
A
A
A、-2 B、0 C、+4 D、+6
(2)写出在烧杯E中发生反应的离子方程式:
CO2+Ba2++2OH-=BaCO3↓+H2O
CO2+Ba2++2OH-=BaCO3↓+H2O
;(3)D中30% 双氧水的作用是
吸收SO2气体
吸收SO2气体
;若无此装置,所测定的含碳量将偏高
偏高
(填“偏高”、“偏低”或“不影响”)(4)反应完成后,欲验证生铁含有硫元素,你所设计的实验方案是(写出实验步骤、现象)
取少量D瓶溶液于试管中,滴加盐酸酸化的BaCl2溶液,若出现白色沉淀,说明生铁中含有硫元素
取少量D瓶溶液于试管中,滴加盐酸酸化的BaCl2溶液,若出现白色沉淀,说明生铁中含有硫元素
;(5)待C管的样品充分反应后,测得E中生成的沉淀为bg,请计算出生铁中的含碳量为
| 1200b |
| 197a |
| 1200b |
| 197a |
(6)实验过程中,该兴趣小组应注意的安全问题是
浓硫酸有腐蚀性,使用时要小心;加热时要使二通管均匀受热等
浓硫酸有腐蚀性,使用时要小心;加热时要使二通管均匀受热等
.(任写一种)