题目内容
铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图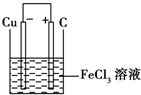
 (标出正、负极材料及电解质溶液),并写出电极反应式.正极反应
(标出正、负极材料及电解质溶液),并写出电极反应式.正极反应
(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显.请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.有关反应的化学方程式①
(4)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2.该电池正极发生的电极反应为
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
2Fe3++Cu═2Fe2++Cu2+
2Fe3++Cu═2Fe2++Cu2+
.(2)若将(1)中的反应设计成原电池,请画出原电池的装置图


2Fe3++2e-═2Fe2+或Fe3++e-═2e2+
2Fe3++2e-═2Fe2+或Fe3++e-═2e2+
,负极反应Cu-2e-═Cu2+
Cu-2e-═Cu2+
.(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显.请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.有关反应的化学方程式①
CuO+H2SO4═CuSO4+H2O
CuO+H2SO4═CuSO4+H2O
②CuSO4+Fe═FeSO4+Cu
CuSO4+Fe═FeSO4+Cu
.劣质不锈钢腐蚀的实验现象不锈钢表面有红色物质生成,溶液颜色由蓝色变成浅绿色
不锈钢表面有红色物质生成,溶液颜色由蓝色变成浅绿色
.(4)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2.该电池正极发生的电极反应为
2SOCl2+4e-═4Cl-+S+SO2
2SOCl2+4e-═4Cl-+S+SO2
.分析:(1)铜和铁离子反应生成亚铁离子和铜离子;
(2)根据反应方程式知,易失电子的金属作负极,不如铜活泼的金属或导电的非金属作正极,氯化铁溶液作电解质溶液,正极上铁离子得电子发生还原反应,负极上铜失电子发生氧化反应;
(3)根据劣质不锈钢能与某些盐溶液反应而被腐蚀,所以要根据所给药品制取盐溶液,制取盐溶液时要考虑环保,且该盐溶液与铁反应时有明显的现象;
(4)正极上得电子发生还原反应.
(2)根据反应方程式知,易失电子的金属作负极,不如铜活泼的金属或导电的非金属作正极,氯化铁溶液作电解质溶液,正极上铁离子得电子发生还原反应,负极上铜失电子发生氧化反应;
(3)根据劣质不锈钢能与某些盐溶液反应而被腐蚀,所以要根据所给药品制取盐溶液,制取盐溶液时要考虑环保,且该盐溶液与铁反应时有明显的现象;
(4)正极上得电子发生还原反应.
解答:解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,
,
故答案为: ;Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+);Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
;Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+);Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
(3)劣质不锈钢能与某些盐溶液反应而被腐蚀,给取的药品没有盐溶液,所以用给取的药品制取盐溶液,可用铜与浓硫酸反应制取硫酸铜溶液,也可用氧化铜和稀硫酸制取硫酸铜溶液,但铜与浓硫酸反应生成有毒气体,不环保,所以用氧化铜和稀硫酸反应制取硫酸铜溶液;硫酸铜和铁反应产生铜单质,所以可观察到不锈钢表面有紫红色物质生成,
故答案为:CuO+H2SO4=CuSO4+H2O;CuSO4+Fe=FeSO4+Cu;不锈钢表面有紫红色物质生成;
(4)正极上得电子发生还原反应,电极反应式为:2SOCl2+4e-═4Cl-+S+SO2,故答案为:2SOCl2+4e-═4Cl-+S+SO2.
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为
 ,
,故答案为:
 ;Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+);Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
;Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+);Cu=2Cu2++2e-(或Cu-2e-=Cu2+);(3)劣质不锈钢能与某些盐溶液反应而被腐蚀,给取的药品没有盐溶液,所以用给取的药品制取盐溶液,可用铜与浓硫酸反应制取硫酸铜溶液,也可用氧化铜和稀硫酸制取硫酸铜溶液,但铜与浓硫酸反应生成有毒气体,不环保,所以用氧化铜和稀硫酸反应制取硫酸铜溶液;硫酸铜和铁反应产生铜单质,所以可观察到不锈钢表面有紫红色物质生成,
故答案为:CuO+H2SO4=CuSO4+H2O;CuSO4+Fe=FeSO4+Cu;不锈钢表面有紫红色物质生成;
(4)正极上得电子发生还原反应,电极反应式为:2SOCl2+4e-═4Cl-+S+SO2,故答案为:2SOCl2+4e-═4Cl-+S+SO2.
点评:本题考查了原电池的工作原理及原电池的设计,难度较大,原电池的设计是学习的重点和难度.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目