摘要:12.⑴2.75mol/L ⑵0 解析: 设12.8g的样品中CuS的物质的量为x .Cu2S的物质的量为y 96x+160y=12.8 8x/3+10y/3=0.3 解得:x=y=0.05mol 根据方程式①.②可知消耗n(H+)=0.05mol×8/3+0.05mol×16/3=0.4mol 故剩余n(H+)=0.1mol.c(H+)=1mol/L pH=0 ⑶11.2L 解析:首先判断64g样品中CuS.Cu2S的物质的量为0.25mol 本题采用极端假设: 若HNO3均与CuS反应:硝酸不足.则V(NO)=0.5mol×22.4L/mol=11.2L 若HNO3均与Cu2S反应:硝酸不足.则V(NO)=0.5mol×22.4L/mol=7L 所以:c中产生气体体积(V)7L<v< 11.2L
网址:http://m.1010jiajiao.com/timu3_id_49457[举报]
A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
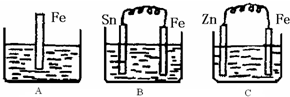
(1)A中反应的离子方程式为
(2)一段时间后,B中Sn极附近溶液的pH
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
查看习题详情和答案>>

(1)A中反应的离子方程式为
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.(2)一段时间后,B中Sn极附近溶液的pH
增大
增大
(填“增大”、“减小”、“不变”).(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
0.75
0.75
mol?L-1.(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
BAC
BAC
(填写序号).(2013?临沂一模)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2
8SO2+2Fe2O3,该反应中被氧化的元素是
(2)实验室中用如图1所示的装置测定SO2催化氧化为SO3,的转化率.(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)
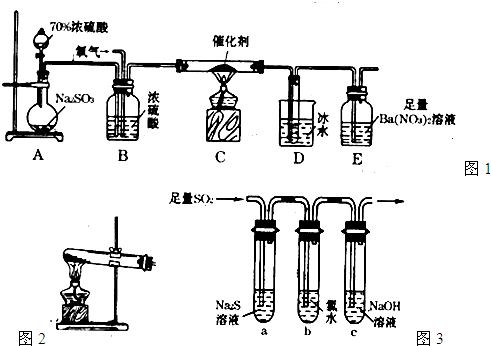
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是
②实验过程中,需要通入氧气.试写出一个用图2所示装置制取氧气的化学方程式
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是
×100%
×100%(用含字母的代数式表示,不用化简).
(3)某学习小组设计用如图3装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=
查看习题详情和答案>>
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2
| ||
Fe、S
Fe、S
(填元素符号).当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为11.2
11.2
L.(2)实验室中用如图1所示的装置测定SO2催化氧化为SO3,的转化率.(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是
打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加
打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加
.②实验过程中,需要通入氧气.试写出一个用图2所示装置制取氧气的化学方程式
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
.
| ||
| △ |
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
使残留在装置中的二氧化硫和三氧化硫被充分吸收
使残留在装置中的二氧化硫和三氧化硫被充分吸收
.④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是
| ||||
|
| ||||
|
(3)某学习小组设计用如图3装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为
试管a中出现淡黄色浑浊
试管a中出现淡黄色浑浊
.②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是
Ⅲ
Ⅲ
(填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-
SO2+Cl2+2H2O=4H++SO42-+2Cl-
.③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=
2c(SO32-)+c(HSO3-)
2c(SO32-)+c(HSO3-)
(用含硫微粒浓度的代数式表示).将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L?min).求:
(1)此时A的浓度c(A)=
(2)B的平均反应速率v(B)=
(3)x的值为
查看习题详情和答案>>
(1)此时A的浓度c(A)=
0.75
0.75
mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=3
3
mol;(2)B的平均反应速率v(B)=
0.05
0.05
mol/(L?min);(3)x的值为
2
2
. 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示.下列叙述正确的是( )
查看习题详情和答案>>
 如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫.
如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫.在催化剂作用下,CO2和H2可以制取甲醇和乙醇.
如:2CO2(g)+6H2(g)
| 催化剂 |
(Ⅰ) 在一定压强下,利用CO2反应制取乙醇,测得反应的实验数据如下表.分析表中数据回答下列问题:
| 温度/k CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”、或“不变”).提高氢碳比[n(H2)/n(CO2)],平衡常数K值将不变
不变
(填“增大”、“减小”、或“不变”).(2)在600K时反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
AB
AB
(填序号).A.缩小反应器体积 B.通入CO2 C.升高温度到800K D.使用合适的催化剂
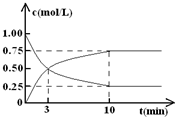
(Ⅱ)某温度下,在体积为l L的密闭容器中充入lmol CO2和4mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
(1)从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
0.075mol/(L?min)
0.075mol/(L?min)
;(2)氢气的平衡浓度为
1.75
1.75
mol/L.