题目内容
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L?min).求:
(1)此时A的浓度c(A)=
(2)B的平均反应速率v(B)=
(3)x的值为
(1)此时A的浓度c(A)=
0.75
0.75
mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=3
3
mol;(2)B的平均反应速率v(B)=
0.05
0.05
mol/(L?min);(3)x的值为
2
2
.分析:(1)根据化学方程和物质的量浓度的计算式思考;
(2)根据评价反应速率公式计算;
(3)根据化学方程式计算.
(2)根据评价反应速率公式计算;
(3)根据化学方程式计算.
解答:解:(1)5min后,n(D)=0.5mol/L×2L═1mol,
根据3A(g)+B(g)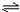 xC(g)+2D(g),生成1molD要消耗1.5molA和0.5molB,
xC(g)+2D(g),生成1molD要消耗1.5molA和0.5molB,
设初始时A、B的物质的量均为n,则(n-1.5):(n-0.5)═3:5,即n=3.
c(A)═
═0.75mol/L.故答案为:0.75;3;
(2)v(B)═
═0.05mol/(L?min),故答案为:0.05;
(3)n(C)═0.1mol/(L?min)×5min×2L═1mol,
n(D)=0.5mol/L×2L═1mol,
根据3A(g)+B(g)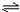 xC(g)+2D(g),n(C):n(D)═1:1,
xC(g)+2D(g),n(C):n(D)═1:1,
因为生成C和D的物质的量之比等化学计量数之比,所以n═2,故答案为:2.
根据3A(g)+B(g)
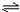 xC(g)+2D(g),生成1molD要消耗1.5molA和0.5molB,
xC(g)+2D(g),生成1molD要消耗1.5molA和0.5molB,设初始时A、B的物质的量均为n,则(n-1.5):(n-0.5)═3:5,即n=3.
c(A)═
| 3mol-1.5mol |
| 2L |
(2)v(B)═
| 0.5mol |
| 2L?5min |
(3)n(C)═0.1mol/(L?min)×5min×2L═1mol,
n(D)=0.5mol/L×2L═1mol,
根据3A(g)+B(g)
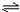 xC(g)+2D(g),n(C):n(D)═1:1,
xC(g)+2D(g),n(C):n(D)═1:1,因为生成C和D的物质的量之比等化学计量数之比,所以n═2,故答案为:2.
点评:本题需要根据化学反应速率的计算公式和化学方程式计算,能很好地训练思维能力.

练习册系列答案
相关题目
 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求: xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求: xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min).求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min).求: