题目内容
A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
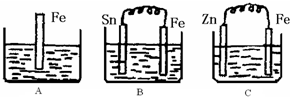
(1)A中反应的离子方程式为
(2)一段时间后,B中Sn极附近溶液的pH
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是

(1)A中反应的离子方程式为
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.(2)一段时间后,B中Sn极附近溶液的pH
增大
增大
(填“增大”、“减小”、“不变”).(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
0.75
0.75
mol?L-1.(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
BAC
BAC
(填写序号).分析:(1)铁为活泼金属,与酸发生置换反应生成氢气;
(2)Fe与Sn在酸性溶液中形成原电池,Sn为正极,电极反应式为H++2e-=H2↑;
(3)根据氢气的体积计算硫酸的物质的量,根据溶液的体积计算物质的量浓度;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
(2)Fe与Sn在酸性溶液中形成原电池,Sn为正极,电极反应式为H++2e-=H2↑;
(3)根据氢气的体积计算硫酸的物质的量,根据溶液的体积计算物质的量浓度;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
解答:解:(1)铁为活泼金属,与酸发生置换反应生成氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
(2)Fe与Sn在酸性溶液中形成原电池,Sn为正极,电极反应式为H++2e-=H2↑,Sn极附近溶液的H+浓度减小,pH增大,故答案为:增大;
(3)电池总反应为:H2SO4+Fe=FeSO4+H2↑,
n(H2SO4)=n(H2)=
=0.15mol,
则:c(H2SO4)=
=0.75mol/L,
故答案为:0.75;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护,腐蚀速率最小,故答案为:BAC.
故答案为:Fe+2H+=Fe2++H2↑;
(2)Fe与Sn在酸性溶液中形成原电池,Sn为正极,电极反应式为H++2e-=H2↑,Sn极附近溶液的H+浓度减小,pH增大,故答案为:增大;
(3)电池总反应为:H2SO4+Fe=FeSO4+H2↑,
n(H2SO4)=n(H2)=
| 3.36L |
| 22.4L/mol |
则:c(H2SO4)=
| 0.15mol |
| 0.2L |
故答案为:0.75;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护,腐蚀速率最小,故答案为:BAC.
点评:本题考查金属的腐蚀与防护,题目难度不大,注意比较金属腐蚀快慢的方法.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案
相关题目