摘要:39.现有A.B.C.D.E五种短周期元素.其中元素A.B.C组成的化合物俗称“烧碱 .D是最重要半导体材料.它的高纯度单质是制造电脑CPU芯片的主要材料.而E的单质是一种常用于杀菌消毒的气体.有关高纯度D单质的生产流程如下: 试回答下列问题: (1)E-的核外电子排布式为 .C2B2的电子式为 . (2)电负性:D元素 E元素.(填:“> .“< 或“= ) (3)预测D的氢化物的空间构成的空间构型为 .化合物丙中的D元素原子轨道发生的是 杂化.固态时丙属于 晶体. (4)化合物A2B的沸点高于化合物乙的沸点的主要原因是 . (5)已知D单质的结构与金刚石类似.如右图所示.则该晶体中D原子数与D-D单键的数目比为 .该晶胞的边长为a.D的摩尔质量为M单位:g·mol-1).阿佛加德罗常数为NA.则该晶体的密度为 g·cm-3.
网址:http://m.1010jiajiao.com/timu3_id_49307[举报]
现有A、B、C、D、E五种核电荷数小于18的元素,其中:A原子核内无中子,B原子最外层电子数是次外层的2倍,C原子最外层电子数是其电子层数的3倍,D原子核外K层比M层电子数多1,,E形成的-1价离子与Ar原子核外电子排布相同;
由此推知:
(1)A原子符号是
(2)B原子结构示意图是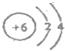
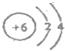
(3)E元素形成的单质与A、C、D三元素形成呈碱性的化合物反应的方程式:
查看习题详情和答案>>
由此推知:
(1)A原子符号是
11H
11H
;(2)B原子结构示意图是
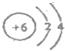
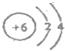
(3)E元素形成的单质与A、C、D三元素形成呈碱性的化合物反应的方程式:
2NaOH+Cl2═NaCl+NaClO+H2O
2NaOH+Cl2═NaCl+NaClO+H2O
.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:
(2)写出E溶液与过量的B溶液反应的离子方程式:
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l);△H=-a KJ?mol-1.
请写出B与C的稀溶液反应的热化学方程式
(4)在100mL 0.1mol?L-1E溶液中,逐滴加入35mL 2mol?L-1NaOH溶液,最终得到沉淀物质的量为
查看习题详情和答案>>
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:
c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
.(2)写出E溶液与过量的B溶液反应的离子方程式:
2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓
2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓
.(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l);△H=-a KJ?mol-1.
请写出B与C的稀溶液反应的热化学方程式
OH-(aq)+H+(aq)=H2O(1)△H=-aKJ/mol或
Ba(OH)2(aq)+2HC1(aq)=
BaC12(aq)+H2O(1)△H=-aKJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+H2O(1)△H=-2aKJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+H2O(1)△H=-2aKJ/mol
OH-(aq)+H+(aq)=H2O(1)△H=-aKJ/mol或
Ba(OH)2(aq)+2HC1(aq)=
BaC12(aq)+H2O(1)△H=-aKJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+H2O(1)△H=-2aKJ/mol
.| 1 |
| 2 |
| 1 |
| 2 |
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+H2O(1)△H=-2aKJ/mol
(4)在100mL 0.1mol?L-1E溶液中,逐滴加入35mL 2mol?L-1NaOH溶液,最终得到沉淀物质的量为
0.01mol
0.01mol
.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应均能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)A、B、C、D、E的化学式分别为 、 、 、 、 ;
(2)常温下,浓度均为0.1mol?L-1的A、B溶液中H2O的电离程度的关系是A B(填“<”、“>”或“=”);
(3)在100mL 0.1mol?L-1 E溶液中,逐滴加入35mL,2mol?L-1NaOH溶液,最终得到沉淀的物质的量为 mol.
查看习题详情和答案>>
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应均能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)A、B、C、D、E的化学式分别为
(2)常温下,浓度均为0.1mol?L-1的A、B溶液中H2O的电离程度的关系是A
(3)在100mL 0.1mol?L-1 E溶液中,逐滴加入35mL,2mol?L-1NaOH溶液,最终得到沉淀的物质的量为
(2010?杭州二模)现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)A溶液呈碱性的原因是
(2)写出E溶液与过量的B溶液反应的离子方程式
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=-a kJ?mol-1.请写出相同条件下B与C的稀溶液反应的热化学方程式
(4)若25℃时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度
(5)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中的一价(+1或-1)离子浓度由大到小的顺序为:
查看习题详情和答案>>
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO4- |
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
试回答下列问题:
(1)A溶液呈碱性的原因是
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.(2)写出E溶液与过量的B溶液反应的离子方程式
2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓
2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓
.(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=-a kJ?mol-1.请写出相同条件下B与C的稀溶液反应的热化学方程式
Ba(OH)2(ap)+2HCl(ap)═BaCl2(ap)+2H2O(l)△H=-2akJ?mol-1;
Ba(OH)2(ap)+2HCl(ap)═BaCl2(ap)+2H2O(l)△H=-2akJ?mol-1;
.(4)若25℃时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度
106
106
倍.(5)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中的一价(+1或-1)离子浓度由大到小的顺序为:
c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)
c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)
.现有A、B、C、D、E五种短周期元素,其中A、B两种元素同主族,A元素原子的最外层电子数是内层电子的数3倍;C是所有元素中原子半径最小的;D的气态氢化物水溶液能使湿润的红色石蕊试纸变蓝;在A、E形成的化合物EA中,A、E离子核外电子数均为10.请按要求回答下列问题:
Ⅰ.(1)写出元素E在元素周期表的位置
(2)在A、B、D分别形成的氢化物中,最稳定的氢化物是
Ⅱ.元素C、D形成的单质在一定条件下发生反应,生成化合物F,该反应是一种重要的化工反应.
(1)写出上述反应的化学方程式
(2)在一定条件下,将a mol C单质和b mol D单质的混合气体通入20L的密闭容器中,发生上述反应.若反应进行到20min时,测得C单质和化合物F的物质的量分别为11mol和6mol.计算:
①a 的值
②用D单质表示该反应的化学反应速率.
(3)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中F的含量(体积分数)为25%,计算平衡时F的物质的量.
查看习题详情和答案>>
Ⅰ.(1)写出元素E在元素周期表的位置
第三周期第ⅡA族
第三周期第ⅡA族
;(2)在A、B、D分别形成的氢化物中,最稳定的氢化物是
H2O
H2O
(填化学式).Ⅱ.元素C、D形成的单质在一定条件下发生反应,生成化合物F,该反应是一种重要的化工反应.
(1)写出上述反应的化学方程式
N2+3H2
2NH3
| ||
| 高温高压 |
N2+3H2
2NH3
;
| ||
| 高温高压 |
(2)在一定条件下,将a mol C单质和b mol D单质的混合气体通入20L的密闭容器中,发生上述反应.若反应进行到20min时,测得C单质和化合物F的物质的量分别为11mol和6mol.计算:
①a 的值
②用D单质表示该反应的化学反应速率.
(3)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中F的含量(体积分数)为25%,计算平衡时F的物质的量.