摘要:18.现有下列短周期元素性质的数据: 元素编号 元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ 原子半径 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82 最高或 最低化合价 -2 +2 +1 +5 -3 +7 -1 +1 +5 -3 +3 下列说法正确的是: A.元素④的原子序数小于元素⑦的原子序数 B.②.③处于同一周期 C.上述八种元素最高价氧化物对应的水化物中.⑤号酸性最强 D.⑧号元素原子结构示意图为:
网址:http://m.1010jiajiao.com/timu3_id_49260[举报]
(2009?兖州市模拟)下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.

(1)写出g元素在周期表中的位置:
(2)下列
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(3)现有下列短周期元素性质的数据:
试回答下列问题:
I.上述元素中①、②、⑥分别为
II.元素④与元素⑦相比较,气态氢化物较稳定的是
III.工业上获取⑤单质的主要化学反应方程式为:
IV.⑤和⑥形成的化合物中化学键是
V.⑦的最高价氧化物的水化物和其氢化物反应生成的盐溶液显酸性的原因是什么?(用必要的离子方程式说明).
查看习题详情和答案>>

(1)写出g元素在周期表中的位置:
第四周期,第ⅣA族
第四周期,第ⅣA族
.(2)下列
①④
①④
(填写编号)组元素的单质可能都是电的良导体.①a、c、h ②b、g、k ③c、h、l ④d、e、f
(3)现有下列短周期元素性质的数据:
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高增化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
I.上述元素中①、②、⑥分别为
O、Mg、Na
O、Mg、Na
,上述元素中处于第二周期的有Li、N、O
Li、N、O
(以上均用元素符号表示).II.元素④与元素⑦相比较,气态氢化物较稳定的是
NH3
NH3
(填化学式).III.工业上获取⑤单质的主要化学反应方程式为:
2NaCl+2H2O
2NaCl+Cl2↑+H2↑
| ||
2NaCl+2H2O
2NaCl+Cl2↑+H2↑
.
| ||
IV.⑤和⑥形成的化合物中化学键是
离子键
离子键
.V.⑦的最高价氧化物的水化物和其氢化物反应生成的盐溶液显酸性的原因是什么?(用必要的离子方程式说明).
(2009?上海一模)现有下列短周期元素性质的有关数据:
(1)根据元素周期律确定a至j十种元素在周期表中的位置,将它们的元素编号填入下表相应的空格内.
(2)上述10种元素形成的氢化物中,分子间存在氢键的有(填氢化物的化学式)
(3)i在b的氧化物中燃烧的方程式为
(4)h和d所形成的化合物的电子式为
 .
.
(5)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式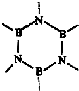
 .
.
查看习题详情和答案>>
| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 |
+2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | a a |
b b |
c c |
j j |
||||
| 3 | h h |
i i |
e e |
g g |
d d |
f f |
||
HF、NH3
HF、NH3
.(3)i在b的氧化物中燃烧的方程式为
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
(4)h和d所形成的化合物的电子式为


(5)原子数相同,电子总数相同的分子或离子互称等电子体.在元素周期表中,与碳相邻的两种元素可形成具有石墨型晶体结构的“白石墨”,“白石墨”和石墨具有等电子体特征,画出“白石墨”的最小结构单元的结构式


现有下列短周期元素性质的数据:
试回答下列问题:
(1)上述元素中处于第 VA族的有 ,处于第二周期的有 (以上均用编号表示).
(2)上述元素中金属性最强的是 (用编号表示).
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式 .
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n-m)≥0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n-m)<0时,该元素属于非金属元素.试回答:
a.第n(n≥2)周期有 种非金属元素(用含n的代数式表示,含零族元素).
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有 种非金属元素(含零族元素),还有 种未发现,未发现的非金属处在第 周期第 族(注:将零族看作 VIIIA族).
查看习题详情和答案>>
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于第 VA族的有
(2)上述元素中金属性最强的是
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n-m)≥0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n-m)<0时,该元素属于非金属元素.试回答:
a.第n(n≥2)周期有
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有
现有下列短周期元素性质的数据:
试回答下列问题:
(1)上述元素中处于ⅤA族的有:
(2)处于第二周期的元素有:
(3)写出②、⑤的元素符号:
(4)④和⑤两元素中非金属性较强的是(写元素名称)
(5)由五个⑦原子形成一种显电性的粒子,该粒子中每个⑦原子均满足8电子结构,且五个⑦原子排成V型,则该粒子的表达式是
查看习题详情和答案>>
| 元素编号元素性质 | ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于ⅤA族的有:
④⑦
④⑦
(用编号表示)(2)处于第二周期的元素有:
①③⑦
①③⑦
被称为“矾”的一类化合物中肯定含有表中①
①
(以上均用编号表示).(3)写出②、⑤的元素符号:
Mg、Cl
Mg、Cl
(4)④和⑤两元素中非金属性较强的是(写元素名称)
Cl
Cl
写出证明这一结论的一个实验事实.高氯酸酸性比磷酸强(氯化氢比磷化氢稳定)
高氯酸酸性比磷酸强(氯化氢比磷化氢稳定)
(5)由五个⑦原子形成一种显电性的粒子,该粒子中每个⑦原子均满足8电子结构,且五个⑦原子排成V型,则该粒子的表达式是
N5+
N5+
.现有下列短周期元素性质的数据:
试回答下列问题:
(1)元素③在周期表中位置是 ; 元素④与元素⑦相比较,气态氢化物较稳定的是 (填化学式);
(2)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学方程式 ;
(3)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式 ;
(4)元素①单质和元素⑧单质在海水中可以形成原电池,写出正极反应 .
查看习题详情和答案>>
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) |
0.74 | 1.02 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
(1)元素③在周期表中位置是
(2)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学方程式
(3)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式
(4)元素①单质和元素⑧单质在海水中可以形成原电池,写出正极反应