摘要:25 ℃时.pH=2的盐酸中.由水电离出的c(H+)是 A.1×10-7 mol·L-1 B.1×10-12 mol·L-1 C.1×10-2 mol·L-1 D.1×10-14 mol·L-1
网址:http://m.1010jiajiao.com/timu3_id_48668[举报]
25℃时,几种弱酸溶液的pH如下表所示:
(1)25℃时,Na2SO3溶液的pH______(填“>”、“<”“或“=”)7,其原因是______(用离子方程式表示).
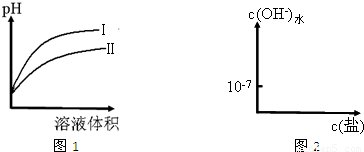
(2)图1是常温下,相同pH的CH3COOH和HCN溶液分别加水稀释时溶液的pH随溶液体积变化的曲线.
①图1中曲线______(填“Ⅰ”或“Ⅱ”)表示加水稀释HCN溶液时pH的变化.
②下列操作能使CH3COOH的电离程度与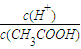 同时增大的是______.
同时增大的是______.
A.加水稀释溶液 B.升高溶液温度 C.加入少量NaHSO4固体 D.加入少量CH3COONa固体
③在图2中分别画出常温下CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与其盐浓度的变化曲线.
(3)常温下,物质的量浓度相同的CH3COONa溶液和NaCN溶液中,CH3COONa溶液中各离子浓度之和______(填“>”、“<”或“=”)NaCN溶液中各离子浓度之和.
(4)已知:HCN(aq)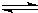 H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ?mol-1则NaCN在溶液中发生水解的热化学方程式:
CN-(aq)+H2O(1)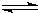 HCN(aq)+OH-(aq)的△H=______.该反应25℃时的平衡常数K=______.
HCN(aq)+OH-(aq)的△H=______.该反应25℃时的平衡常数K=______.
(需填具体数值,已知10-5.6=2.5×10-6)
查看习题详情和答案>>
| 弱酸 | CH3COOH | H2SO3 | HCN |
| 物质的量浓度mol/L | 0.01 | 0.01 | 0.01 |
| pH | 3.4 | 2.3 | 5.6 |

(1)25℃时,Na2SO3溶液的pH______(填“>”、“<”“或“=”)7,其原因是______(用离子方程式表示).
(2)图1是常温下,相同pH的CH3COOH和HCN溶液分别加水稀释时溶液的pH随溶液体积变化的曲线.
①图1中曲线______(填“Ⅰ”或“Ⅱ”)表示加水稀释HCN溶液时pH的变化.
②下列操作能使CH3COOH的电离程度与
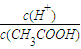 同时增大的是______.
同时增大的是______.A.加水稀释溶液 B.升高溶液温度 C.加入少量NaHSO4固体 D.加入少量CH3COONa固体
③在图2中分别画出常温下CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与其盐浓度的变化曲线.
(3)常温下,物质的量浓度相同的CH3COONa溶液和NaCN溶液中,CH3COONa溶液中各离子浓度之和______(填“>”、“<”或“=”)NaCN溶液中各离子浓度之和.
(4)已知:HCN(aq)
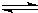 H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ?mol-1则NaCN在溶液中发生水解的热化学方程式:
CN-(aq)+H2O(1)
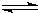 HCN(aq)+OH-(aq)的△H=______.该反应25℃时的平衡常数K=______.
HCN(aq)+OH-(aq)的△H=______.该反应25℃时的平衡常数K=______.(需填具体数值,已知10-5.6=2.5×10-6)
查看习题详情和答案>>