摘要:23. 重晶石(BaSO4)难溶于水.要转化成BaCO3再制备其他钡盐.工业上一般采用高温煅烧还原法,实验室可以采用沉淀转化法. ●高温煅烧还原法 (1)煅烧还原的热化学方程式为: 有关的数据:Ba+2O2(g)=BaSO4(s),△H= -1473.2 kJ·mol-1 C(s)+O2,△H= -110.5 kJ·mol-1 Ba,△H= -460kJ·mol-1 (2)经检验BaS的水溶液呈碱性.原因是 ●沉淀转化法 向BaSO4沉淀中加入饱和Na2CO3溶液.充分搅拌.弃去上层清液.如此处理多次.直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32―(aq)BaCO3(s)+SO42― (3)现有0.20 mol BaSO4.每次用1.00 L 2.0mol·L-1饱和Na2CO3溶液处理.假定BaSO4能全部转化.至少需要处理多少次? (4)从“绿色化学 角度分析.用饱和Na2CO3溶液沉淀转化法的优点是
网址:http://m.1010jiajiao.com/timu3_id_48393[举报]
(2009?中山模拟)重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐.工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法.
●高温煅烧还原法

(1)煅烧还原的热化学方程式为:
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+
O2(g)=CO(g);△H=-110.5kJ?mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示):
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq)≒BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(3)现有0.20mol BaSO4,每次用1.00L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
查看习题详情和答案>>
●高温煅烧还原法

(1)煅烧还原的热化学方程式为:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+
| 1 | 2 |
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示):
S2-+H2O HS-+OH-
HS-+OH-
 HS-+OH-
HS-+OH-S2-+H2O HS-+OH-
HS-+OH-
. HS-+OH-
HS-+OH-●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq)≒BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(3)现有0.20mol BaSO4,每次用1.00L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
节能,环保
节能,环保
.重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐.工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法.
●高温煅烧还原法
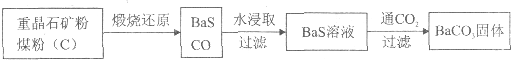
(1)煅烧还原的热化学方程式为 .
有关的数据:Ba(s)+S(s)+202(g)=BaSO4(s)△H=-1.47321kJ?mol-1
C(s)+
02(g)=CO(g)△H=-110.51kJ?mol-1
Ba(s)+S(s)=BaS(s)△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示) .
●沉淀转化法
BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO
(aq)?BaCO3(s)+SO42-(aq)(平衡常数K=O.042)
(3)现有0.20mol BaSO4,每次用1.0L 2.0mol?L-1饱和Na2CO3溶液处理,BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,射饱和Na2CO3溶液沉淀转化法的优点是 .
(5)火力发电厂燃煤排烟,释放出大量的氮氧化物、二氧化碳等气体.某热电厂同时具有烟气脱硝、脱硫、二氧化碳捕集(脱碳)设施,成为高效、节能、绿色环保燃煤电厂.其中脱硝采用催化还原法,C0(NH2)2 (尿素)作还原剂,在加热条件下催化还原氮氧化物,1mol CO(NH2)2反应时失去6mol电子,请写出尿素与二氧化氮反应的化学方程式 .
查看习题详情和答案>>
●高温煅烧还原法

(1)煅烧还原的热化学方程式为
有关的数据:Ba(s)+S(s)+202(g)=BaSO4(s)△H=-1.47321kJ?mol-1
C(s)+
| 1 |
| 2 |
Ba(s)+S(s)=BaS(s)△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
●沉淀转化法
BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO
2- 3 |
(3)现有0.20mol BaSO4,每次用1.0L 2.0mol?L-1饱和Na2CO3溶液处理,BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,射饱和Na2CO3溶液沉淀转化法的优点是
(5)火力发电厂燃煤排烟,释放出大量的氮氧化物、二氧化碳等气体.某热电厂同时具有烟气脱硝、脱硫、二氧化碳捕集(脱碳)设施,成为高效、节能、绿色环保燃煤电厂.其中脱硝采用催化还原法,C0(NH2)2 (尿素)作还原剂,在加热条件下催化还原氮氧化物,1mol CO(NH2)2反应时失去6mol电子,请写出尿素与二氧化氮反应的化学方程式
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐.工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法.
●高温煅烧还原法

(1)煅烧还原的热化学方程式为:______
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+ O2(g)=CO(g);△H=-110.5kJ?mol-1
O2(g)=CO(g);△H=-110.5kJ?mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示):______.
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq)≒BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(3)现有0.20mol BaSO4,每次用1.00L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是______.
查看习题详情和答案>>
●高温煅烧还原法

(1)煅烧还原的热化学方程式为:______
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+
 O2(g)=CO(g);△H=-110.5kJ?mol-1
O2(g)=CO(g);△H=-110.5kJ?mol-1Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示):______.
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq)≒BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(3)现有0.20mol BaSO4,每次用1.00L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是______.
查看习题详情和答案>>
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐.工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法.
●高温煅烧还原法
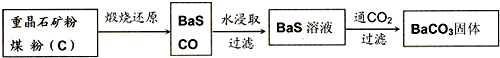
(1)煅烧还原的热化学方程式为:______
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+
O2(g)=CO(g);△H=-110.5kJ?mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示):______.
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq)≒BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(3)现有0.20mol BaSO4,每次用1.00L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是______.
查看习题详情和答案>>
●高温煅烧还原法

(1)煅烧还原的热化学方程式为:______
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+
| 1 |
| 2 |
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示):______.
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq)≒BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(3)现有0.20mol BaSO4,每次用1.00L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是______.
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐。工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法。
●高温煅烧还原法

(1)煅烧还原的热化学方程式为:
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s); △H= -1473.2 kJ?mol-1
C(s)+ ![]() O2(g)=CO(g); △H= -110.5 kJ?mol-1
O2(g)=CO(g); △H= -110.5 kJ?mol-1
Ba(s)+S(s)=BaS(s); △H= -460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32(aq)![]() BaCO3(s)+SO42(aq)(平衡常数K=0.042)
BaCO3(s)+SO42(aq)(平衡常数K=0.042)
(3)现有0.20 mol BaSO4,每次用1.00 L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
查看习题详情和答案>>