摘要:蓝色世界 (1)基态:CuSO4 . CuSO4 •5H2O .液氧.臭氧 (2)化学变化: ①紫色石蕊在碱性溶液中变蓝. ②润湿的红色石蕊试纸遇碱性气体变蓝. ③无水 CuSO4 遇水变蓝. ④H2.H2S . CH4 .C2H5OH 燃烧火焰呈淡兰色.CO燃烧火焰呈蓝色. ⑤S8在空气中燃烧呈淡蓝色火焰.在纯氧中燃烧呈现明亮的蓝紫色火焰. ⑥淀粉遇 I2 (aq)变蓝. ⑦Cl2 . Br2 . NO2 .O3遇湿润的淀粉碘化钾试纸变蓝
网址:http://m.1010jiajiao.com/timu3_id_47598[举报]
 【化学--选修3物质结构与性质】
【化学--选修3物质结构与性质】下表是元素周期表的一部分,其中A-G分别代表一种元素.
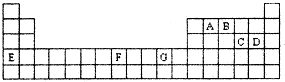
请根据表中所列元素,回答下列问题:
(1)所列元素中第一电离能最小的是
(2)AC2分子的空间构型是
(3)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物的溶解度,原因是
(4)基态G2+的核外电子排布式是
 该配离子中含有的化学键类型有
该配离子中含有的化学键类型有a.配位键 b.极性键 c.离子键 d.非极性键
(5)化合物EF[F(AB)6]是一种常见的蓝笆晶体,其中的AB-与B2为等电子体,则AB-的电子式为
| 1 | 8 |
[化学--选修物质结构与性质]下表为元素周期表的一部分.请回答下列问题:
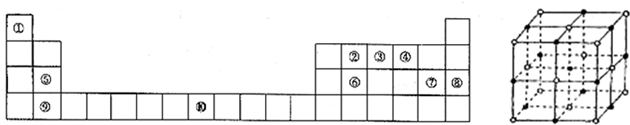
(1)上述元素中,属于s区的是
(3)元素第一电离能为⑤
(4)元素③气态氢化物的中心原子有
(5)元素⑦的钠盐晶胞结构如图所示,每个Na+周围与之距离最近的Na+的个数为
g/cm3
g/cm3.
查看习题详情和答案>>

(1)上述元素中,属于s区的是
H、Mg、Ca
H、Mg、Ca
(填元素符号).(2)写出元素⑩的基态原子的电子排布式1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
.(3)元素第一电离能为⑤
大于
大于
⑨(填“大于”或“小于”).(4)元素③气态氢化物的中心原子有
1
1
对弧对电子,其VSEPR模型为正四面体
正四面体
;中心原子的杂化类型为sp3
sp3
;该分子为极性
极性
分子(填“极性”或“非极性”).向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为先产生蓝色沉淀,后溶解得深蓝色溶液
先产生蓝色沉淀,后溶解得深蓝色溶液
.(5)元素⑦的钠盐晶胞结构如图所示,每个Na+周围与之距离最近的Na+的个数为
12
12
.若设该晶胞的棱长为a cm,阿伏加德罗常数的值为NA,则该钠盐的密度为| 234 |
| NAa3 |
| 234 |
| NAa3 |
 (2013?江苏三模)研究证明,Fe、Fe2+、Fe3+易与CO、CN-等形成配合物.
(2013?江苏三模)研究证明,Fe、Fe2+、Fe3+易与CO、CN-等形成配合物.(1)配合物Fe(CO)5会使合成氨等生产过程中的催化剂中毒.
①Fe(CO)5中铁的化合价为0,写出铁原子基态的电子排布式:
1s22s22p63s23p63d64s2或[Ar]3d64s2
1s22s22p63s23p63d64s2或[Ar]3d64s2
.该物质中含有的化学键类型有BD
BD
(填字母).A.离子键 B.极性共价键C.非极性共价键D.配位键
②常温下Fe(CO)5呈液态,熔点为-20.5℃,沸点为103℃.据此可以判断Fe(CO)5晶体的类型为
分子晶体
分子晶体
.(2)Fe、Fe2+都能被硝酸氧化.硝酸中氮原子轨道的杂化类型为
sp2
sp2
.(3)若向氯化铁溶液中加入少量的K4[Fe(CN)6]溶液,可生成蓝色沉淀KFe[Fe(CN)6],如图所示的是该晶体晶胞的八分之一(K+未画出).
①写出与CN-互为等电子体的一种分子的化学式:
N2
N2
.②该晶体的一个晶胞中含有的K+的个数为
4
4
.(化学--选修物质结构与性质)
A、B、C、D、E、F、G七种元素,它们的原子序数依次增大,除G外均为前20号元素.A原子基态时p能级原子轨道上电子数等于次外层电子数,C元素的原子基态时s能级与p能级上的电子数相等,C、D有相同的能级,且D是同期中电负性最大的元素,E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575,F元素原子中4s能级有2个电子.G元素的离子形成的硫酸盐结晶水合物呈蓝色.
(1)B形成的单质中有
(2)G元素的基态原子的价层电子排布式为
(3)常温下,E单质投入到B的最高价氧化物对应的水化物的浓溶液中的现象是
(4)D、F组成的晶体FD2结构如图Ⅰ所示,G形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3(硼酸)晶体结构图

①图I所示的FD2晶体中与F离子最近且等距离的F离子数为
②晶体FD2和H3BO3(硼酸)晶体之间的熔点由高到低的排列顺序为
(填空化学式),H3BO3晶体中存在的作用力除共价键以外还有
查看习题详情和答案>>
A、B、C、D、E、F、G七种元素,它们的原子序数依次增大,除G外均为前20号元素.A原子基态时p能级原子轨道上电子数等于次外层电子数,C元素的原子基态时s能级与p能级上的电子数相等,C、D有相同的能级,且D是同期中电负性最大的元素,E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575,F元素原子中4s能级有2个电子.G元素的离子形成的硫酸盐结晶水合物呈蓝色.
(1)B形成的单质中有
2
2
个Π键,上述元素形成的化合物中和B的单质是等电子体的是CO
CO
(填化学式)(2)G元素的基态原子的价层电子排布式为
3d104s1
3d104s1
.(3)常温下,E单质投入到B的最高价氧化物对应的水化物的浓溶液中的现象是
无明显现象
无明显现象
.(4)D、F组成的晶体FD2结构如图Ⅰ所示,G形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3(硼酸)晶体结构图

①图I所示的FD2晶体中与F离子最近且等距离的F离子数为
12
12
,图III中未标号的G原子形成晶体后周围最紧邻的G原子数为12
12
;②晶体FD2和H3BO3(硼酸)晶体之间的熔点由高到低的排列顺序为
CaF2>H3BO3
CaF2>H3BO3
(填空化学式),H3BO3晶体中存在的作用力除共价键以外还有
分子间作用力、氢键
分子间作用力、氢键
. (2011?崇川区三模)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
(2011?崇川区三模)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.(1)基态的F3+核外电子排布式是
1s22s22p63s23p63d5
1s22s22p63s23p63d5
.(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是
NH3与H2O分子间存在氢键,其他分子与H2O分子间不存在氢键
NH3与H2O分子间存在氢键,其他分子与H2O分子间不存在氢键
.(3)化合物FD3是棕色固体、易潮解、100℃左右时升华,它的晶体类型是
分子晶体
分子晶体
;化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是[ ]-
]-
 ]-
]-[ ]-
]-
. ]-
]-(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是
K2Fe(SCN)5
K2Fe(SCN)5
.(5)化合物EF[F(AB)6]是一种蓝色晶体,如图甲表示其晶胞的
| 1 |
| 8 |
4
4
.(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图乙所示,其晶胞边长为540.0pm,密度为
4.1
4.1
(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为| 270 | ||
|
| 270 | ||
|