摘要:14.下列叙述正确的是( ) A.将稀氨水逐滴加入稀硫酸中.当溶液的pH=7时.c(SO42-)>c(NH4+) B.两种醋酸溶液的物质的量浓度分别为c1和c2.pH的别为a和a+1.则c1=10c2 C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合.滴入石蕊溶液呈红色 D.向0.1mol·L-1的氨水中加入少量硫酸铵固体.则溶液中c(OH-)/c(NH3·H2O)增大 [解析]A中将稀氨水加入硫酸中.=7时.溶液中c(H+)=c(OH-). 根据电荷守恒原则.2c(SO42-)=c(NH4+).即c(SO42-)<c(NH4+).错误,B中由于醋酸是弱酸.故其PH相差10倍时.物质的量浓度不是相差10倍.错误,C中由于醋酸是弱酸.其在弱溶液中不完全电离.其电离部分恰好和氢氧化钠反应.未电离部分过量.故溶液呈酸性.滴入石蕊呈红色.正确,D中加硫酸铵时.电离产生的铵根离子使平衡左移.c(OH-)/c(NH3.H2O)减小.错误. [答案]C [高考考点]溶液中离子浓度比较.弱电解质电离平衡及其移动 [易错提醒]不能正确理解弱电解质电离的平衡的存在.造成BCD项错误判断 [备考提示]解答离子浓度大小比较试题.抓住一个原理.两类平衡.三种守恒进行分析.包括化学平衡移动原理.电离平衡和水解平衡.电荷守恒.物料守恒和质子守恒.其中电荷守恒是指溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数.溶液电中性, 物料守恒是指某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和,质子守恒是指溶液中由水电离出来的H+和OH-总是相等的.质子守恒可由电荷守恒和物料守恒联立推导出来.
网址:http://m.1010jiajiao.com/timu3_id_47496[举报]
图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:
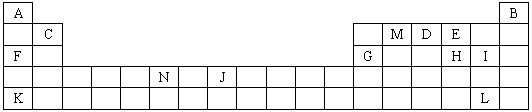
(1)上述所列元素的原子中,最外层电子层上只有两个电子的是
(2)下列叙述正确的是
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
f.电负性由大到小的顺序:E>D>M
g.第一电离能由大到小的顺序:E>D>M
(3)预测DA4+离子的空间构型为
(4)向含有CoCl3?5NH3的溶液中加入硝酸银溶液,可析出AgCl沉淀.经测定,每1mol CoCl3?5NH3只生成2molAgCl.
请写出表示此配合物结构的化学式(钴的配位数为6):
查看习题详情和答案>>

(1)上述所列元素的原子中,最外层电子层上只有两个电子的是
He、Be、Fe
He、Be、Fe
;(填“元素符号”)(2)下列叙述正确的是
a、c、d、f
a、c、d、f
;(填字母序号)a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
f.电负性由大到小的顺序:E>D>M
g.第一电离能由大到小的顺序:E>D>M
(3)预测DA4+离子的空间构型为
正四面体型
正四面体型
,ME2的空间构型为直线型
直线型
;(4)向含有CoCl3?5NH3的溶液中加入硝酸银溶液,可析出AgCl沉淀.经测定,每1mol CoCl3?5NH3只生成2molAgCl.
请写出表示此配合物结构的化学式(钴的配位数为6):
Co(NH3)5Cl]Cl2
Co(NH3)5Cl]Cl2
,此配合物中Co的化合价为+3
+3
. (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.请回答:
(1)X的电子式
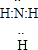
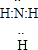
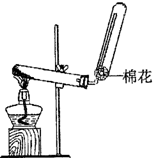
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O;
| ||
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O;
.
| ||
(2)已知:W+X+H2O一白色沉淀,为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,
加入足量的氢氧化钠溶液,若观察到白色沉淀溶解,则证明W为Al3+;若观察到白色沉淀不溶解,则证明W为Mg2+
加入足量的氢氧化钠溶液,若观察到白色沉淀溶解,则证明W为Al3+;若观察到白色沉淀不溶解,则证明W为Mg2+
.(3)常温下,取10mL pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为
HF
HF
,下列叙述正确的是a、b
a、b
(选填字母).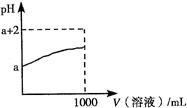
a.Y的水溶液可用作刻蚀玻璃
b.相同温度时与相同浓度的盐酸比较,Y的水溶液的导电能力弱
c.稀释后,阴离子的物质的量浓度之和增大
(4)分子Z中所含元素对应的单质A及A与B形成的化合物可进行如下转化:

当n=1时,请写出A-ABn的化学方程式
C+H2
CO+H2(或2C+SiO2
Si+2CO)
| ||
| ||
C+H2
CO+H2(或2C+SiO2
Si+2CO)
(写出一个即可).
| ||
| ||
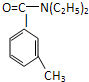 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH| SOCl2 |
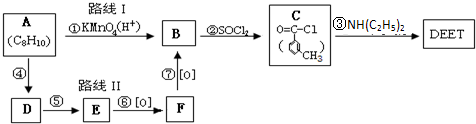
根据以上信息回答下列问题:
(1)由避蚊胺的结构简式推测,下列叙述正确的是
A、D
A、D
.A.它能使酸性高锰酸钾溶液褪色 B.它能发生酯化反应
C.它与甲苯互为同系物 D.一定条件下,它可与H2发生加成反应
(2)在反应①~⑦中,属于取代反应的有
②③④⑤
②③④⑤
(填序号).(3)写出下列化学反应方程式:C→DEET




(4)经测定E的同分异构体能与FeCl3溶液发生显色的反应,且结构中不含乙基,试写出符合其条件的任意2个可能的结构简式
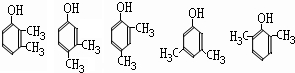 (任写2种)
(任写2种) (任写2种)
(任写2种)(5)经核磁共振氢谱图显示A的某种同分异构体J只有两个吸收峰(及两种环境的氢原子),试写出J的化学名称
1,4二甲基苯或对二甲苯
1,4二甲基苯或对二甲苯
;J物质被酸性高锰酸钾氧化后得到的产物在一定条件下可与乙二醇反应,制成涤纶(聚酯纤维),试写出生产涤纶的化学方程式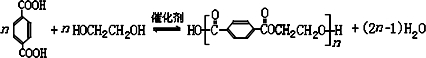

贝诺酯是由扑热息痛、阿司匹林经化学法拼合制备的解热镇痛抗炎药,其合成如下(反应条件略去):
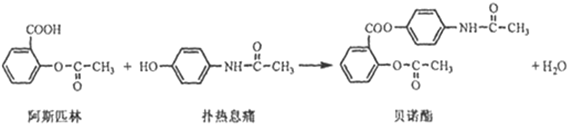
(1)扑热息痛的分子式是
(2)下列叙述正确的是
A、生成贝诺酯的反应属于取代反应
B、FeCl3溶液可区别阿司匹林和扑热息痛
C、常温下贝诺酯在水中的溶解度小于扑热息痛
D、贝诺酯既是酯类物质,也是氨基酸
(3)1mol阿司匹林最多可跟 mol的H2反应.
(4)写出阿司匹林与足量的NaOH溶液反应的化学方程式 .
(5)病人服用贝诺酯或阿司匹林,都能在消化液的作用下发生水解反应,且有两种产物相同,其中属芳香族化合物的结构简式是
(6)扑热息痛可由对氨基苯酚和乙酸酐[(CH3CO)20]在一定条件下制备,写出其反应的化学方程式 .
查看习题详情和答案>>

(1)扑热息痛的分子式是
(2)下列叙述正确的是
A、生成贝诺酯的反应属于取代反应
B、FeCl3溶液可区别阿司匹林和扑热息痛
C、常温下贝诺酯在水中的溶解度小于扑热息痛
D、贝诺酯既是酯类物质,也是氨基酸
(3)1mol阿司匹林最多可跟
(4)写出阿司匹林与足量的NaOH溶液反应的化学方程式
(5)病人服用贝诺酯或阿司匹林,都能在消化液的作用下发生水解反应,且有两种产物相同,其中属芳香族化合物的结构简式是
(6)扑热息痛可由对氨基苯酚和乙酸酐[(CH3CO)20]在一定条件下制备,写出其反应的化学方程式
如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:

(1)如图中将铁元素在周期表中的位置是
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时
(4)下列叙述正确的是
A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:
查看习题详情和答案>>

(1)如图中将铁元素在周期表中的位置是
第4周期第Ⅷ族
第4周期第Ⅷ族
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式
Na+[:H]-
Na+[:H]-
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时
促进
促进
(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(4)下列叙述正确的是
A、D、E
A、D、E
.A.h的最高价氧化物对应的水化物是一种强碱
B.f的氢化物比硒化氢的稳定性弱
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:
3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
.