题目内容
图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:

(1)上述所列元素的原子中,最外层电子层上只有两个电子的是
(2)下列叙述正确的是
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
f.电负性由大到小的顺序:E>D>M
g.第一电离能由大到小的顺序:E>D>M
(3)预测DA4+离子的空间构型为
(4)向含有CoCl3?5NH3的溶液中加入硝酸银溶液,可析出AgCl沉淀.经测定,每1mol CoCl3?5NH3只生成2molAgCl.
请写出表示此配合物结构的化学式(钴的配位数为6):

(1)上述所列元素的原子中,最外层电子层上只有两个电子的是
He、Be、Fe
He、Be、Fe
;(填“元素符号”)(2)下列叙述正确的是
a、c、d、f
a、c、d、f
;(填字母序号)a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
f.电负性由大到小的顺序:E>D>M
g.第一电离能由大到小的顺序:E>D>M
(3)预测DA4+离子的空间构型为
正四面体型
正四面体型
,ME2的空间构型为直线型
直线型
;(4)向含有CoCl3?5NH3的溶液中加入硝酸银溶液,可析出AgCl沉淀.经测定,每1mol CoCl3?5NH3只生成2molAgCl.
请写出表示此配合物结构的化学式(钴的配位数为6):
Co(NH3)5Cl]Cl2
Co(NH3)5Cl]Cl2
,此配合物中Co的化合价为+3
+3
.分析:(1)稀有气体He,第二主族元素C为Be及表中的J为Fe,它们的最外层电子数为2;
(2)a.K为Rb,其金属性比Na的强,则RbOH为强碱,故a正确;
b.S的非金属性大于Se,非金属性越强,气态氢化物越稳定;
c.NaCl溶液的pH=7,Na2S的水溶液的pH>7,相同浓度氢化物水溶液的酸性H2S弱于HCl;
d.CH2O分子中C原子采取sp2杂化方式;
e.Cr的电子排布式为ls22s22p63s23p63d54s1;
f.非金属性越强,电负性越大;
g.非金属强,第一电离能大,但氮原子的2p为半满,为稳定结构,则第一电离能最大;
(3)NH4+离子中N原子采取sp3杂化方式,CO2中C原子采取sp杂化方式;
(4)1molCoCl3?5NH3只生成2molAgCl,则1molCoCl3?5NH3中有2molCl-为外界离子,钴的配位数为6,则配体为NH3和Cl-,由正负化合物的代数和为0来计算化合价.
(2)a.K为Rb,其金属性比Na的强,则RbOH为强碱,故a正确;
b.S的非金属性大于Se,非金属性越强,气态氢化物越稳定;
c.NaCl溶液的pH=7,Na2S的水溶液的pH>7,相同浓度氢化物水溶液的酸性H2S弱于HCl;
d.CH2O分子中C原子采取sp2杂化方式;
e.Cr的电子排布式为ls22s22p63s23p63d54s1;
f.非金属性越强,电负性越大;
g.非金属强,第一电离能大,但氮原子的2p为半满,为稳定结构,则第一电离能最大;
(3)NH4+离子中N原子采取sp3杂化方式,CO2中C原子采取sp杂化方式;
(4)1molCoCl3?5NH3只生成2molAgCl,则1molCoCl3?5NH3中有2molCl-为外界离子,钴的配位数为6,则配体为NH3和Cl-,由正负化合物的代数和为0来计算化合价.
解答:解:(1)稀有气体He,第二主族元素及表中的J,它们的最外层电子数为2,故答案为:He、Be、Fe;
(2)a.K为Rb,其金属性比Na的强;
b.S的非金属性大于Se,非金属性越强,气态氢化物越稳定,硒化氢的稳定性弱于S的氢化物的热稳定性,故b错误;
c.NaCl溶液的pH=7,Na2S的水溶液的pH>7,相同浓度氢化物水溶液的酸性H2S弱于HCl,故c正确;
d.CH2O分子为平面三角形,则C原子采取sp2杂化方式,故d正确;
e.Cr的电子排布式为ls22s22p63s23p63d54s1,故e错误;
f.非金属性越强,电负性越大,E、D、M在同周期,同周期元素从左到右非金属性在增强,则电负性由大到小的顺序为E>D>M,故f正确;
g.非金属强,第一电离能大,但氮原子的2p为半满,为稳定结构,则第一电离能最大,则第一电离能为D>E>M,故g错误;
故答案为:a、c、d、f;
(3)NH4+离子中N原子采取sp3杂化方式,则空间构型为正四面体型,CO2中C原子采取sp杂化方式,则空间构型为直线型,故答案为:正四面体型;直线型;
(4)1molCoCl3?5NH3只生成2molAgCl,则1molCoCl3?5NH3中有2molCl-为外界离子,钴的配位数为6,则配体为NH3和Cl-,此配合物结构的化学式为Co(NH3)5Cl]Cl2,由正负化合物的代数和为0可知,Co元素的化合价为0-3×(-1)=+3,
故答案为:Co(NH3)5Cl]Cl2;+3.
(2)a.K为Rb,其金属性比Na的强;
b.S的非金属性大于Se,非金属性越强,气态氢化物越稳定,硒化氢的稳定性弱于S的氢化物的热稳定性,故b错误;
c.NaCl溶液的pH=7,Na2S的水溶液的pH>7,相同浓度氢化物水溶液的酸性H2S弱于HCl,故c正确;
d.CH2O分子为平面三角形,则C原子采取sp2杂化方式,故d正确;
e.Cr的电子排布式为ls22s22p63s23p63d54s1,故e错误;
f.非金属性越强,电负性越大,E、D、M在同周期,同周期元素从左到右非金属性在增强,则电负性由大到小的顺序为E>D>M,故f正确;
g.非金属强,第一电离能大,但氮原子的2p为半满,为稳定结构,则第一电离能最大,则第一电离能为D>E>M,故g错误;
故答案为:a、c、d、f;
(3)NH4+离子中N原子采取sp3杂化方式,则空间构型为正四面体型,CO2中C原子采取sp杂化方式,则空间构型为直线型,故答案为:正四面体型;直线型;
(4)1molCoCl3?5NH3只生成2molAgCl,则1molCoCl3?5NH3中有2molCl-为外界离子,钴的配位数为6,则配体为NH3和Cl-,此配合物结构的化学式为Co(NH3)5Cl]Cl2,由正负化合物的代数和为0可知,Co元素的化合价为0-3×(-1)=+3,
故答案为:Co(NH3)5Cl]Cl2;+3.
点评:本题考查元素周期表及元素周期律,考查知识点较多,难度较大,熟悉元素的性质是解答本题的关键.

练习册系列答案
相关题目
元素周期表是学习化学的重要工具,右图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是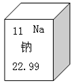
| A.该元素的名称是钠 | B.该元素的原子序数为11 |
| C.该元素在地壳中的含量为22.99% | D.该元素的元素符号为Na |
 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
