摘要:74.该研究小组对市桥洪水发生的原因的调查结果.最不可信的是 ( ) A.在旧城改造过程中.填埋了许多池塘和河道 B.大面积铺设水泥.沥青路面影响了地表水的下渗 C.城市道路排水设施不够完善 D.城市居民不再使用井水.导致了地下水位升高
网址:http://m.1010jiajiao.com/timu3_id_46869[举报]
某研究小组对铁生锈进行研究.
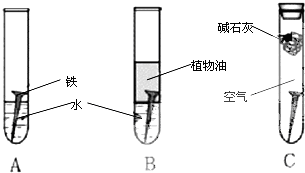
(1)经过较长时间后,甲同学观察到的现象是:上述图中的铁钉最容易生锈的是
(2)在铁钉的锈蚀过程中,Fe发生了
(3)铁生锈的外部条件是
(4)若为了防止铁钉生锈,该同学想在铁钉表面镀上一层金属,该金属最好是
A.锡 B.铜 C.锌.
查看习题详情和答案>>

(1)经过较长时间后,甲同学观察到的现象是:上述图中的铁钉最容易生锈的是
A
A
(2)在铁钉的锈蚀过程中,Fe发生了
氧化
氧化
(填“氧化”或“还原”)反应(3)铁生锈的外部条件是
潮湿的空气
潮湿的空气
(4)若为了防止铁钉生锈,该同学想在铁钉表面镀上一层金属,该金属最好是
C
C
A.锡 B.铜 C.锌.
某研究小组对铁生锈进行研究.
(1)甲同学设计了A、B、C一组实验(如图1),探究铁生锈的条件.经过较长时间后,甲同学观察到的现象是:A中铁钉生锈;B中铁钉不生锈;C中铁钉不生锈.
①通过上述实验现象分析,可得出铁生锈的外部条件是
②铁钉发生电化腐蚀的正极电极反应式为
③实验B所用的水要经过
④实验C中碱石灰的作用是
(2)乙同学为了达到同样目的,设计了实验D(如图1),发现一段时间后,试管中的液面升高,其原因是
(3)丙同学为了探究铁锈(Fe2O3?nH2O)的组成,将甲同学实验产生的铁锈刮下来,称取1.96g这种铁锈,按如图2所示装置进行实验.充分反应后,称得B装置的质量增加0.36g,C装置的质量增加1.32g,则根据实验数据,推断铁锈的化学式中n值为

查看习题详情和答案>>
(1)甲同学设计了A、B、C一组实验(如图1),探究铁生锈的条件.经过较长时间后,甲同学观察到的现象是:A中铁钉生锈;B中铁钉不生锈;C中铁钉不生锈.
①通过上述实验现象分析,可得出铁生锈的外部条件是
和空气以及水接触
和空气以及水接触
;②铁钉发生电化腐蚀的正极电极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;③实验B所用的水要经过
煮沸
煮沸
处理;植物油的作用是隔绝空中的氧气和水蒸气
隔绝空中的氧气和水蒸气
;④实验C中碱石灰的作用是
吸收空气中的水蒸气
吸收空气中的水蒸气
.(2)乙同学为了达到同样目的,设计了实验D(如图1),发现一段时间后,试管中的液面升高,其原因是
液面上升的原因是铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压
液面上升的原因是铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压
,该实验不能
不能
(填“能”或“不能”)说明水对铁钉生锈产生影响.(3)丙同学为了探究铁锈(Fe2O3?nH2O)的组成,将甲同学实验产生的铁锈刮下来,称取1.96g这种铁锈,按如图2所示装置进行实验.充分反应后,称得B装置的质量增加0.36g,C装置的质量增加1.32g,则根据实验数据,推断铁锈的化学式中n值为
2
2
.
某课外兴趣小组对H2O2的分解速率做了如下实验探究.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)

①该研究小组在设计方案时.考虑了浓度、
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测定结果如下:
①写出H2O2发生的化学反应方程式
②实验结果说明催化剂作用的大小与
查看习题详情和答案>>
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)

①该研究小组在设计方案时.考虑了浓度、
温度
温度
、催化剂
催化剂
等因素对过氧化氢分解速率的影响.②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响
温度升高化学反应速率加快;反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快
温度升高化学反应速率加快;反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快
.(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测定结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
②实验结果说明催化剂作用的大小与
接触面积
接触面积
有关.化合物A为某矿物样品的主要成分,其质量分数为80%,且A仅由Cu、Fe、S三种元素组成.某研究小组对其组成进行分析,具体实验如下(不考虑杂质的影响):
①准确称取2.3g样品,加入足量的浓硝酸充分溶解后过滤,得到滤液B.
②在B中通入过量的氨气,结果溶液呈深蓝色,同时得到1.07g红褐色沉淀.
③在②的滤液中加入足量盐酸,未见沉淀产生,再滴入足量氯化钡溶液,最后得到4.66g白色沉淀.
已知:Cu2O+2H+=Cu2++Cu+H2O,请回答下列问题:
(1)写出氨气的电子式: ,深蓝色离子的化学式: ,A的化学式: .
(2)工业上常利用该矿物与氧气反应熔炼金属Cu,同时也得到气体C和炉渣(主要成分为Fe2O3).
①在新制的C水溶液中滴加一定量的BaCl2溶液,初始观察不到明显现象,充分振荡后,可观察到有白色沉淀产生,且逐渐增多,请解释其原因 .
②冶炼过程中的最后一步是氧化亚铜与硫化亚铜在高温下作用得到金属铜和气体C,写出该步骤发生反应的化学方程式 .该方法冶炼得到的铜往往含有少量氧化亚铜,请设计实验方案检验铜中是否含有氧化亚铜: .
③炉渣中的氧化铁可用来制备高铁酸钾(K2FeO4).K2FeO4是一种集氧化、吸附、絮凝、杀菌、脱嗅于一体,具有绿色、环保、高效等特点的新型水处理剂.研究发现K2FeO4的氧化性比KMnO4、O3还要强,在中性、酸性溶液中稳定性较差,在碱性溶液中稳定性较好.请写出K2FeO4在强酸性溶液中释放出氧气的离子方程式 .K2FeO4之所以能用于净水,除了能消毒外,另一个原因是 .
查看习题详情和答案>>
①准确称取2.3g样品,加入足量的浓硝酸充分溶解后过滤,得到滤液B.
②在B中通入过量的氨气,结果溶液呈深蓝色,同时得到1.07g红褐色沉淀.
③在②的滤液中加入足量盐酸,未见沉淀产生,再滴入足量氯化钡溶液,最后得到4.66g白色沉淀.
已知:Cu2O+2H+=Cu2++Cu+H2O,请回答下列问题:
(1)写出氨气的电子式:
(2)工业上常利用该矿物与氧气反应熔炼金属Cu,同时也得到气体C和炉渣(主要成分为Fe2O3).
①在新制的C水溶液中滴加一定量的BaCl2溶液,初始观察不到明显现象,充分振荡后,可观察到有白色沉淀产生,且逐渐增多,请解释其原因
②冶炼过程中的最后一步是氧化亚铜与硫化亚铜在高温下作用得到金属铜和气体C,写出该步骤发生反应的化学方程式
③炉渣中的氧化铁可用来制备高铁酸钾(K2FeO4).K2FeO4是一种集氧化、吸附、絮凝、杀菌、脱嗅于一体,具有绿色、环保、高效等特点的新型水处理剂.研究发现K2FeO4的氧化性比KMnO4、O3还要强,在中性、酸性溶液中稳定性较差,在碱性溶液中稳定性较好.请写出K2FeO4在强酸性溶液中释放出氧气的离子方程式