题目内容
化合物A为某矿物样品的主要成分,其质量分数为80%,且A仅由Cu、Fe、S三种元素组成.某研究小组对其组成进行分析,具体实验如下(不考虑杂质的影响):
①准确称取2.3g样品,加入足量的浓硝酸充分溶解后过滤,得到滤液B.
②在B中通入过量的氨气,结果溶液呈深蓝色,同时得到1.07g红褐色沉淀.
③在②的滤液中加入足量盐酸,未见沉淀产生,再滴入足量氯化钡溶液,最后得到4.66g白色沉淀.
已知:Cu2O+2H+=Cu2++Cu+H2O,请回答下列问题:
(1)写出氨气的电子式: ,深蓝色离子的化学式: ,A的化学式: .
(2)工业上常利用该矿物与氧气反应熔炼金属Cu,同时也得到气体C和炉渣(主要成分为Fe2O3).
①在新制的C水溶液中滴加一定量的BaCl2溶液,初始观察不到明显现象,充分振荡后,可观察到有白色沉淀产生,且逐渐增多,请解释其原因 .
②冶炼过程中的最后一步是氧化亚铜与硫化亚铜在高温下作用得到金属铜和气体C,写出该步骤发生反应的化学方程式 .该方法冶炼得到的铜往往含有少量氧化亚铜,请设计实验方案检验铜中是否含有氧化亚铜: .
③炉渣中的氧化铁可用来制备高铁酸钾(K2FeO4).K2FeO4是一种集氧化、吸附、絮凝、杀菌、脱嗅于一体,具有绿色、环保、高效等特点的新型水处理剂.研究发现K2FeO4的氧化性比KMnO4、O3还要强,在中性、酸性溶液中稳定性较差,在碱性溶液中稳定性较好.请写出K2FeO4在强酸性溶液中释放出氧气的离子方程式 .K2FeO4之所以能用于净水,除了能消毒外,另一个原因是 .
①准确称取2.3g样品,加入足量的浓硝酸充分溶解后过滤,得到滤液B.
②在B中通入过量的氨气,结果溶液呈深蓝色,同时得到1.07g红褐色沉淀.
③在②的滤液中加入足量盐酸,未见沉淀产生,再滴入足量氯化钡溶液,最后得到4.66g白色沉淀.
已知:Cu2O+2H+=Cu2++Cu+H2O,请回答下列问题:
(1)写出氨气的电子式:
(2)工业上常利用该矿物与氧气反应熔炼金属Cu,同时也得到气体C和炉渣(主要成分为Fe2O3).
①在新制的C水溶液中滴加一定量的BaCl2溶液,初始观察不到明显现象,充分振荡后,可观察到有白色沉淀产生,且逐渐增多,请解释其原因
②冶炼过程中的最后一步是氧化亚铜与硫化亚铜在高温下作用得到金属铜和气体C,写出该步骤发生反应的化学方程式
③炉渣中的氧化铁可用来制备高铁酸钾(K2FeO4).K2FeO4是一种集氧化、吸附、絮凝、杀菌、脱嗅于一体,具有绿色、环保、高效等特点的新型水处理剂.研究发现K2FeO4的氧化性比KMnO4、O3还要强,在中性、酸性溶液中稳定性较差,在碱性溶液中稳定性较好.请写出K2FeO4在强酸性溶液中释放出氧气的离子方程式
分析:(1)氨气是氮原子和氢原子之间通过共价键形成的共价化合物,1.07g红褐色沉淀是氢氧化铁,4.66g白色沉淀是硫酸钡,根据样品质量、铁元素质量以及硫元素质量守恒来计算Cu元素的量,进而确定分子式;
(2)①二氧化硫溶于水得到亚硫酸,亚硫酸易被氧化为硫酸,可以和氯化钡反应生成硫酸钡;
②根据氧化亚铜和硫化亚铜高温下的反应产物是金属铜和二氧化硫来书写方程式,根据Cu2O+2H+=Cu2++Cu+H2O来检验氧化亚铜的存在即可;
③根据高铁酸钾的强氧化性,对应还原产物是三价铁离子,并结合K2FeO4在强酸性溶液中释放出氧气的反应来书写.
(2)①二氧化硫溶于水得到亚硫酸,亚硫酸易被氧化为硫酸,可以和氯化钡反应生成硫酸钡;
②根据氧化亚铜和硫化亚铜高温下的反应产物是金属铜和二氧化硫来书写方程式,根据Cu2O+2H+=Cu2++Cu+H2O来检验氧化亚铜的存在即可;
③根据高铁酸钾的强氧化性,对应还原产物是三价铁离子,并结合K2FeO4在强酸性溶液中释放出氧气的反应来书写.
解答:解:(1)氨气是氮原子和氢原子之间通过共价键形成的共价化合物,电子式为: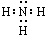 ,A仅由Cu、Fe、S三种元素组成,样品加入足量的浓硝酸充分溶解后过滤,得到的滤液中通入过量的氨气铜离子和氨水反应生成的氢氧化铜会继续溶解于氨水中,得到的深蓝色物质是Cu(NH3)42+,同时得到1.07g红褐色沉淀氢氧化铁,所以铁的物质的量是
,A仅由Cu、Fe、S三种元素组成,样品加入足量的浓硝酸充分溶解后过滤,得到的滤液中通入过量的氨气铜离子和氨水反应生成的氢氧化铜会继续溶解于氨水中,得到的深蓝色物质是Cu(NH3)42+,同时得到1.07g红褐色沉淀氢氧化铁,所以铁的物质的量是
=0.01mol,在②的滤液中加入足量盐酸再滴入足量氯化钡溶液,最后得到4.66g白色沉淀即为硫酸钡,所以含硫的物质的量是
=0.02mol,根据样品中A的质量是2.3g×80%=1.84g,所以含铜的物质的量是
=0.01mol,原子的物质的量之比等于个数之比,所以A的分子式为:CuFeS2,故答案为: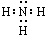 ;Cu(NH3)42+;CuFeS2;
;Cu(NH3)42+;CuFeS2;
(2)①根据题意知道:CuFeS2和氧气反应可以得到金属Cu,同时也得到气体二氧化硫和炉渣氧化铁Fe2O3,二氧化硫溶于水中得到亚硫酸,但是亚硫酸与BaCl2溶液不反应,当充分振荡时,亚硫酸被空气中的氧气氧化生成硫酸,硫酸与BaCl2溶液作用生成BaSO4白色沉淀,故答案为:亚硫酸与BaCl2溶液不反应,当充分振荡时,亚硫酸被空气中的氧气氧化生成硫酸,硫酸与BaCl2溶液作用生成BaSO4白色沉淀;
②氧化亚铜和硫化亚铜高温下的反应产物是金属铜和二氧化硫,即2Cu2O+Cu2S
6Cu+SO2,根据提干信息:Cu2O+2H+=Cu2++Cu+H2O,可以向固体中加入盐酸,观察溶液是否变蓝来检验固体成分,故答案为:2Cu2O+Cu2S
6Cu+SO2;取少量样品于小试管中,滴加稀盐酸(稀硫酸),若溶液呈蓝色,则含有Cu2O;
(4)高铁酸钾的强氧化性,对应还原产物是三价铁离子,在强酸性溶液中释放出氧气的反应为:4FeO42-+20 H+=4Fe3++10H2O+3O2↑,K2FeO4被还原成Fe3+后,三价铁会水解产生Fe(OH)3胶体,该胶体能够吸附水中的悬浮物,达到净化的目的,
故答案为:4FeO42-+20H+=4Fe3++10H2O+3O2↑;K2FeO4被还原成Fe3+后,产生Fe(OH)3胶体,吸附水中的悬浮物,达到净化的目的.
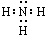 ,A仅由Cu、Fe、S三种元素组成,样品加入足量的浓硝酸充分溶解后过滤,得到的滤液中通入过量的氨气铜离子和氨水反应生成的氢氧化铜会继续溶解于氨水中,得到的深蓝色物质是Cu(NH3)42+,同时得到1.07g红褐色沉淀氢氧化铁,所以铁的物质的量是
,A仅由Cu、Fe、S三种元素组成,样品加入足量的浓硝酸充分溶解后过滤,得到的滤液中通入过量的氨气铜离子和氨水反应生成的氢氧化铜会继续溶解于氨水中,得到的深蓝色物质是Cu(NH3)42+,同时得到1.07g红褐色沉淀氢氧化铁,所以铁的物质的量是| 1.07g |
| 107g/mol |
| 4.66g |
| 233g/mol |
| 1.84g-0.01mol×56g/mol-0.02mol×32g/mol |
| 64g/mol |
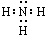 ;Cu(NH3)42+;CuFeS2;
;Cu(NH3)42+;CuFeS2;(2)①根据题意知道:CuFeS2和氧气反应可以得到金属Cu,同时也得到气体二氧化硫和炉渣氧化铁Fe2O3,二氧化硫溶于水中得到亚硫酸,但是亚硫酸与BaCl2溶液不反应,当充分振荡时,亚硫酸被空气中的氧气氧化生成硫酸,硫酸与BaCl2溶液作用生成BaSO4白色沉淀,故答案为:亚硫酸与BaCl2溶液不反应,当充分振荡时,亚硫酸被空气中的氧气氧化生成硫酸,硫酸与BaCl2溶液作用生成BaSO4白色沉淀;
②氧化亚铜和硫化亚铜高温下的反应产物是金属铜和二氧化硫,即2Cu2O+Cu2S
| ||
| ||
(4)高铁酸钾的强氧化性,对应还原产物是三价铁离子,在强酸性溶液中释放出氧气的反应为:4FeO42-+20 H+=4Fe3++10H2O+3O2↑,K2FeO4被还原成Fe3+后,三价铁会水解产生Fe(OH)3胶体,该胶体能够吸附水中的悬浮物,达到净化的目的,
故答案为:4FeO42-+20H+=4Fe3++10H2O+3O2↑;K2FeO4被还原成Fe3+后,产生Fe(OH)3胶体,吸附水中的悬浮物,达到净化的目的.
点评:本题涉及金属元素以及化合物的性质知识,还考查学生有关物质组成和含量的测定等知识,属于综合知识的考查,要求学生具有分析和解决问题的能力,难度大.

练习册系列答案
相关题目