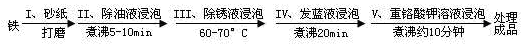题目内容
某研究小组对铁生锈进行研究.
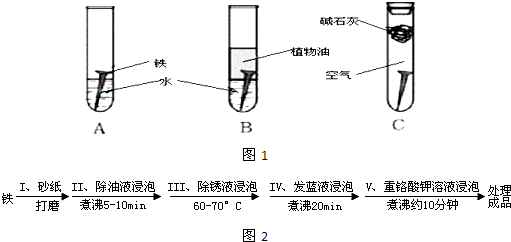
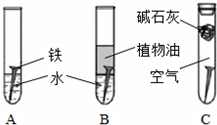
(1)甲同学设计了A、B、C一组实验(如图1),探究铁生锈的条件.经过较长时间后,甲同学观察到的现象是:A中铁钉生锈;B中铁钉不生锈;C中铁钉不生锈.
①通过上述实验现象分析,可得出铁生锈的外部条件是
②铁钉发生电化腐蚀的正极电极反应式为
③实验B所用的水要经过
④实验C中碱石灰的作用是
(2)乙同学为了达到同样目的,设计了实验D(如图1),发现一段时间后,试管中的液面升高,其原因是
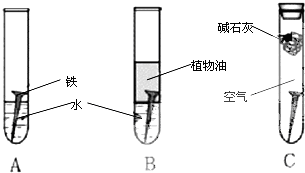
(3)丙同学为了探究铁锈(Fe2O3?nH2O)的组成,将甲同学实验产生的铁锈刮下来,称取1.96g这种铁锈,按如图2所示装置进行实验.充分反应后,称得B装置的质量增加0.36g,C装置的质量增加1.32g,则根据实验数据,推断铁锈的化学式中n值为

(1)甲同学设计了A、B、C一组实验(如图1),探究铁生锈的条件.经过较长时间后,甲同学观察到的现象是:A中铁钉生锈;B中铁钉不生锈;C中铁钉不生锈.
①通过上述实验现象分析,可得出铁生锈的外部条件是
和空气以及水接触
和空气以及水接触
;②铁钉发生电化腐蚀的正极电极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;③实验B所用的水要经过
煮沸
煮沸
处理;植物油的作用是隔绝空中的氧气和水蒸气
隔绝空中的氧气和水蒸气
;④实验C中碱石灰的作用是
吸收空气中的水蒸气
吸收空气中的水蒸气
.(2)乙同学为了达到同样目的,设计了实验D(如图1),发现一段时间后,试管中的液面升高,其原因是
液面上升的原因是铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压
液面上升的原因是铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压
,该实验不能
不能
(填“能”或“不能”)说明水对铁钉生锈产生影响.(3)丙同学为了探究铁锈(Fe2O3?nH2O)的组成,将甲同学实验产生的铁锈刮下来,称取1.96g这种铁锈,按如图2所示装置进行实验.充分反应后,称得B装置的质量增加0.36g,C装置的质量增加1.32g,则根据实验数据,推断铁锈的化学式中n值为
2
2
.
分析:(1)①铁在潮湿的空气中易发生电化学腐蚀,隔绝空气或在干燥的空气中难以形成原电池反应;
②铁发生电化学腐蚀时,正极上是氧气发生得电子的还原反应;
③将水煮沸可以将水中的空气排出,植物油和水是互不相溶的;
④碱石灰是可以吸水的.
(2)根据金属铁生锈的电化学原理来解释;
(3)结合方程式,根据固体减少的质量与浓硫酸增重的质量列关系式计算n值
②铁发生电化学腐蚀时,正极上是氧气发生得电子的还原反应;
③将水煮沸可以将水中的空气排出,植物油和水是互不相溶的;
④碱石灰是可以吸水的.
(2)根据金属铁生锈的电化学原理来解释;
(3)结合方程式,根据固体减少的质量与浓硫酸增重的质量列关系式计算n值
解答:解:(1)①铁生锈的外部条件是金属要和空气中的水以及氧气接触,故答案为:和空气以及水接触;
②铁钉发生电化腐蚀,负极上铁为活泼金属,易失去电子而被氧化,正极上是氧气发生得电子的反应O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
③水中溶解有一定的空气,煮沸可以将空气排出,植物油和水是互不相溶的,它的作用是隔绝空气和水蒸气,故答案为:煮沸;隔绝空气和水蒸气;
④碱石灰能吸水,它的作用是吸收空气中的水蒸气,故答案为:吸收空气中的水蒸气;
(2)铁生锈会消耗氧气,这样会使试管内压强低于大气压,所以液面上升的原因是铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压,不能证明水对铁钉生锈产生影响,故答案为:铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压;不能;
(3)由题意知,固体质量减少的量为水和氧的量,无水氯化钙吸收的量为水,碱石灰吸收的是二氧化碳,反应方程式为:
Fe2O3?nH2O+3CO
2Fe+3CO2 +nH2O
160+18n 3×44
1.96g 1.32g
所以1.96g×3×44=(160+18n)g×1.32g
解得n=2,
故答案为:2.
②铁钉发生电化腐蚀,负极上铁为活泼金属,易失去电子而被氧化,正极上是氧气发生得电子的反应O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
③水中溶解有一定的空气,煮沸可以将空气排出,植物油和水是互不相溶的,它的作用是隔绝空气和水蒸气,故答案为:煮沸;隔绝空气和水蒸气;
④碱石灰能吸水,它的作用是吸收空气中的水蒸气,故答案为:吸收空气中的水蒸气;
(2)铁生锈会消耗氧气,这样会使试管内压强低于大气压,所以液面上升的原因是铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压,不能证明水对铁钉生锈产生影响,故答案为:铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压;不能;
(3)由题意知,固体质量减少的量为水和氧的量,无水氯化钙吸收的量为水,碱石灰吸收的是二氧化碳,反应方程式为:
Fe2O3?nH2O+3CO
| ||
160+18n 3×44
1.96g 1.32g
所以1.96g×3×44=(160+18n)g×1.32g
解得n=2,
故答案为:2.
点评:本题考查金属腐蚀的化学原理,题目难度不大,注意金属发生电化学腐蚀和化学腐蚀的区别,以及形成电化学腐蚀的条件.

练习册系列答案
相关题目