摘要:2.20 科学家对H2O2结构的认识经历了较为漫长的过程.最初.科学家提出了两种观点:①.②H-O-O-H.式中O→O表示配位键.即共用电子对由某原子单方面提供(在化学反应中氧氧键遇到还原剂时易断裂). 化学家Baeyer和Villiyer为研究H2O2的结构.设计并完成了下列实验: a.将C2H5OH与浓H2SO4反应.生成(C2H5)2SO4和水, b.将制得的(C2H5)2SO4与H2O2反应.只生成A和H2SO4, c.将生成的A与H2反应(已知该反应中H2作还原剂). ⑴用电子式表示①.②两种结构:① .② . ⑵如果H2O2的结构如①所示.实验c中化学反应方程式为 , 假如H2O2的结构如②所示.实验c中化学反应方程式为 . ⑶为了进一步确定H2O2的结构.还需要在实验c后添加一步实验d.请设计d的实验方案
网址:http://m.1010jiajiao.com/timu3_id_46106[举报]
(2009?肇庆二模)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4H2(g)
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K=
.
(2)条件相同时,反应①与反应②相比,转化程度更大的是
(3)在一定压强下,测得反应①的实验数据如下表.分析表中数据回答下列问题:
①温度升高,K值
②提高氢碳比[n(H2)/n(CO2)],K值
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的影响.并对图中横坐标、纵坐标的含义作必要的标注.
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料.
已知:N2 (g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为:
查看习题详情和答案>>
①2CO2(g)+6H2(g)
| 催化剂 |
②2CO(g)+4H2(g)
| 催化剂 |
(1)写出反应①的平衡常数表达式K=
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
| c(C2H5OH)?c3(H2O) |
| c2(CO2)?c6(H 2) |
(2)条件相同时,反应①与反应②相比,转化程度更大的是
②
②
;以CO2为原料合成乙醇的优点是废弃物利用,有利于环保
废弃物利用,有利于环保
(写出一条即可).(3)在一定压强下,测得反应①的实验数据如下表.分析表中数据回答下列问题:
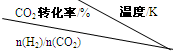 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”、或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值
不变
不变
(填“增大”、“减小”、或“不变”),对生成乙醇有利
有利
(填“有利”或“不利”).(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的影响.并对图中横坐标、纵坐标的含义作必要的标注.
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料.
已知:N2 (g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为:
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ
.(2009?深圳二模)化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:
I、取20.00mL0.250mol/L H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
记录数据如下:
(1)滴定时,KMnO4溶液应装在
(2)滴定终点的判断方法是:
(3)根据上述数据计算,该KMnO4溶液的浓度为
(4)下列操作中使得KMnO4溶液浓度偏低的是
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定前盛放标准H2C2O4溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定管内在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数
II、滴定中发现,KMnO4紫红色褪去的速度开始时很慢、后来变快、最后又变慢.为研究由慢到快的原因,甲同学继续进行了下列实验,实验数据如下表:
(5)分析上述数据,对确定过程中反应速率由慢到快的合理解释是
查看习题详情和答案>>
I、取20.00mL0.250mol/L H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
记录数据如下:
| 滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20.00 | 1.50 | 23.70 |
| 2 | 20.00 | 1.02 | 21.03 |
| 3 | 20.00 | 2.00 | 21.99 |
酸式
酸式
滴定管中(选填:酸式、碱式).(2)滴定终点的判断方法是:
加入最后一滴KMnO4溶液,溶液变为红色,且30s内红色不褪去
加入最后一滴KMnO4溶液,溶液变为红色,且30s内红色不褪去
.(3)根据上述数据计算,该KMnO4溶液的浓度为
0.100
0.100
mol/L.(4)下列操作中使得KMnO4溶液浓度偏低的是
AC
AC
.A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定前盛放标准H2C2O4溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定管内在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数
II、滴定中发现,KMnO4紫红色褪去的速度开始时很慢、后来变快、最后又变慢.为研究由慢到快的原因,甲同学继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另外加少量MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
反应生成的Mn2+对反应起催化剂作用,反应放热使温度升高,加快反应速率快
反应生成的Mn2+对反应起催化剂作用,反应放热使温度升高,加快反应速率快
.
银镜反应是检验醛基的重要反应,教材对该实验的操作条件只是粗略的描述.某同学进行如下研究:
(1)在干净试管中加入2ml 2% ,然后, 得到银氨溶液,分装入5支试管,编号为1#、2#、3#、4#、5#.
(2)依次滴加2%、5%、10%、20%、40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中.3分钟后,试管1#未形成大面积银镜,试管5#的银镜质量差有黑斑,试管4#产生的银镜质量一般,试管2#、3#形成光亮的银镜.该研究的目的是: .
(3)乙醛发生银镜反应的化学方程式为: ,
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜.验证和对比实验如下.
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料后,得知:
a.Ag(NH3)2++2H2O?Ag++2NH3?H2O b.AgOH不稳定,极易分解为黑色Ag2O
经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.产生Ag2O的原因是: .
(5)用湿润的红色石蕊试纸检验NH3产生的现象是 .用稀HNO3清洗试管壁上的Ag,该反应的化学方程式是 .
(6)该同学对产生银镜的原因提出假设:在NaOH存在下,可能是NH3还原Ag2O.如果该假设成立,则说明检验醛基时,银氨溶液不能呈强碱性,因为: .
查看习题详情和答案>>
(1)在干净试管中加入2ml 2%
(2)依次滴加2%、5%、10%、20%、40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中.3分钟后,试管1#未形成大面积银镜,试管5#的银镜质量差有黑斑,试管4#产生的银镜质量一般,试管2#、3#形成光亮的银镜.该研究的目的是:
(3)乙醛发生银镜反应的化学方程式为:
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜.验证和对比实验如下.
| 装置 | 实验序号 | 试管中的药品 | 现象 |
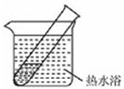 |
实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和 数滴浓氨水 |
有气泡产生:一段时间后,溶液无明显变化 |
a.Ag(NH3)2++2H2O?Ag++2NH3?H2O b.AgOH不稳定,极易分解为黑色Ag2O
经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.产生Ag2O的原因是:
(5)用湿润的红色石蕊试纸检验NH3产生的现象是
(6)该同学对产生银镜的原因提出假设:在NaOH存在下,可能是NH3还原Ag2O.如果该假设成立,则说明检验醛基时,银氨溶液不能呈强碱性,因为:
控制变量法是研究化学变化规侓的重要思想方法.请仔细观察下表中50mL稀盐酸和1g碳酸钙反应的实验数据:
分析并回答下列问题:
(1)本反应属于
(2)实验6和7表明,
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是
(4)本实验中影响反应速率的其它因素还有
查看习题详情和答案>>
| 实验 序号 |
碳酸钙 状态 |
c(HCl) /mol?L-1 |
溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
(1)本反应属于
放热
放热
反应(填吸热或放热).反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
.(2)实验6和7表明,
温度
温度
对反应速率有影响,温度越高
温度越高
反应速率越快,能表明同一规律的实验还有8和9
8和9
(填实验序号).(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是
反应物浓度越大,反应速率越快
反应物浓度越大,反应速率越快
.(4)本实验中影响反应速率的其它因素还有
接触面积
接触面积
,能表明这一规律的实验序号是1、2与4和5
4和5
.(2013?江苏二模)氮的化合物合成、应用及氮的固定一直是科学研究的热点.
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ?mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJ?mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ?mol-1
则a为
(2)反应2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g) 在合成塔中进行.图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况.

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:A.0.6~0.7 B.1~1.1 C.1.5~1.61
生产中应选用水碳比的数值为
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O.
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳.若烟气中V(NO):V(NO2)=5:1时,可通入一定量的空气,同温同压下,V(空气):V(NO)=
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池.请写出该电池的正极反应式
查看习题详情和答案>>
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ?mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJ?mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ?mol-1
则a为
+72.49
+72.49
.(2)反应2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g) 在合成塔中进行.图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况.

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:A.0.6~0.7 B.1~1.1 C.1.5~1.61
生产中应选用水碳比的数值为
A
A
(选填序号).②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是
氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本
氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本
.(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O.
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳.若烟气中V(NO):V(NO2)=5:1时,可通入一定量的空气,同温同压下,V(空气):V(NO)=
1:1
1:1
(空气中氧气的体积含量大约为20%).②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为
5
5
%.(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池.请写出该电池的正极反应式
N2+6e-+8H+=2NH4+
N2+6e-+8H+=2NH4+
.生产中可分离出的物质A的化学式为NH4Cl
NH4Cl
.